
1.2 Основные виды и варианты хроматографии
Любая хроматографическая система включает подвижную и неподвижную фазы, хроматографическую колонку (пластинку в планарной хроматографии), в которой происходит процесс разделения веществ.
Классификация методов хроматографии очень многообразна и может быть проведена на основании:
агрегатного состояния подвижной фазы хроматографической системы: газовая, жидкостная, сверхкритическая флюидная;
используемой неподвижной фазы: газо-твердофазовая, газо-жидкостная, жидкостно-твердофазовая, жидкостно-жидкостная, флюидно-твердофазовая;
способа перемещения сорбата: фронтальная, когда разделяемая смесь подается в колонку непрерывно; элюентная (элютивная, проявительная), когда разделяемая смесь подается в колонку периодически, а элюент - непрерывно, причем элюент удерживается в колонке слабее наименее удерживаемого компонента. Сегодня более 99% всех анализов проводится элюентной хроматографией.
механизма разделения веществ: адсорбционная, распределительная, ситовая (эксклюзионная), ионообменная, лигандообменная, аффинная (биоселективная);
цели разделения: аналитическая,
препаративная, промышленная хроматография;
конфигурации разделяющей системы различают: колоночную, планарную (тонкослойную и бумажную) хроматографию.
В таблице 1 приведена классификация хроматографии в зависимости от агрегатного состояния фаз.
Таблица 1. Варианты хроматографии в зависимости от агрегатного состояния фаз
Подвижная фаза |
Неподвижная фаза |
Наименование |
ГАЗ |
АДСОРБЕНТ |
ГАЗО-АДСОРБ- ЦИОННАЯ |
ГАЗ |
ЖИДКОСТЬ |
ГАЗОЖИД- КОСТНАЯ |
ЖИДКОСТЬ |
АДСОРБЕНТ |
ЖИДКОСТНО-АДСОРБ- ЦИОННАЯ |
ЖИДКОСТЬ |
ЖИДКОСТЬ |
ЖИДКОСТНО-ЖИДКОСТНАЯ |
ВЕЩЕСТВО В СВЕХКРИТИ- ЧЕКОМ СОСТОЯНИИ |
АДСОРБЕНТ |
ФЛЮИДНО-АДСОРБ- ЦИОННАЯ |
ВЕЩЕСТВО В СВЕХКРИТИ- ЧЕКОМ СОСТОЯНИИ |
ЖИДКОСТЬ |
ФЛЮИДНО-ЖИДКОСТНАЯ |
Объектами хроматографического разделения являются различные смеси соединений, которые могут включать инертные газы и высокомолекулярные полимеры. Вещества с молекулярной массой до 500-1000 обычно разделяют методом газовой хроматографии. Флюидная хроматография позволяет разделять вещества с молекулярной массой до 5000. Жидкостная хроматография успешно разделяет соединения с молекулярной массой до 10 000, а для соединений с молекулярной массой свыше 10 000 используется ситовая (эксклюзионная) хроматография.
Если вещества необходимо разделить в форме ионов, то используются различные варианты ионообменной хроматографии.
Аффинная хроматография использует специфическую селективность некоторых биологических и биохимических процессов. Лигандообменная хроматография позволяет разделять даже лево- и право-вращающие изомеры.
Если вещества не удается разделить прямыми методами, то их можно разделить в виде производных. Если необходимо исследовать высокомолекулярное вещество, то его можно подвергнуть пиролизу.
Хроматограмма, полученная после пиролиза может позволить охарактеризовать исходный полимер (дать его “характерный спектр”). Другим косвенным методом для характеристики подобных соединений является обращенная хроматография. В этом случае анализируемое вещество наносится в качестве неподвижной фазы. Об изменениях, происходящих в нем, судят по уменьшению (увеличению) времени удерживания и искажению формы пика нескольких стандартных веществ.
Далее мы будем иметь дело в основном с аналитической хроматографией.
Из рис.1 и 2 следует, что время удерживания
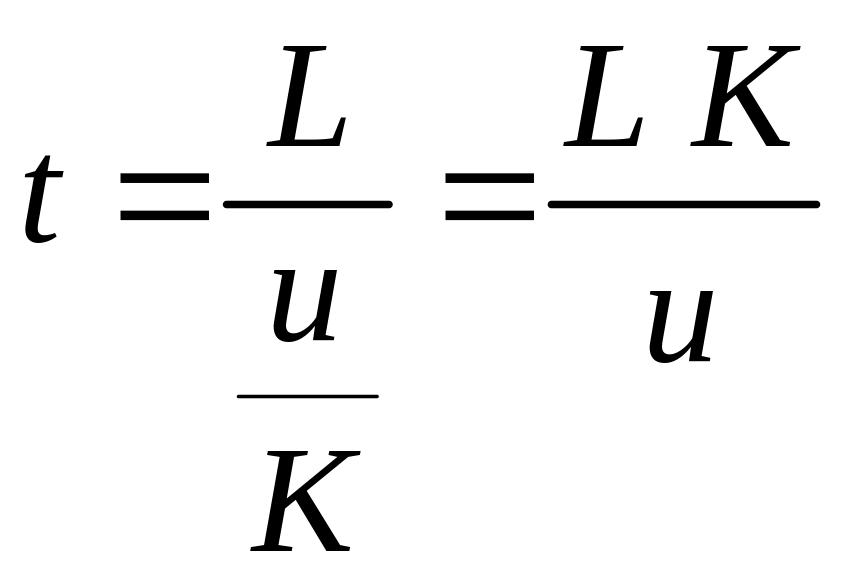 (3)
(3)
где L – длина колонки, u - средняя линейная скорость газа-носителя. Соответственно для несорбирующегося вещества (K = 0)
to = L/u.
Однако уравнение (3) справедливо лишь при условии, что объем неподвижной фазы VS равен объему подвижной фазы VM. Если это не так, то
время удерживания:
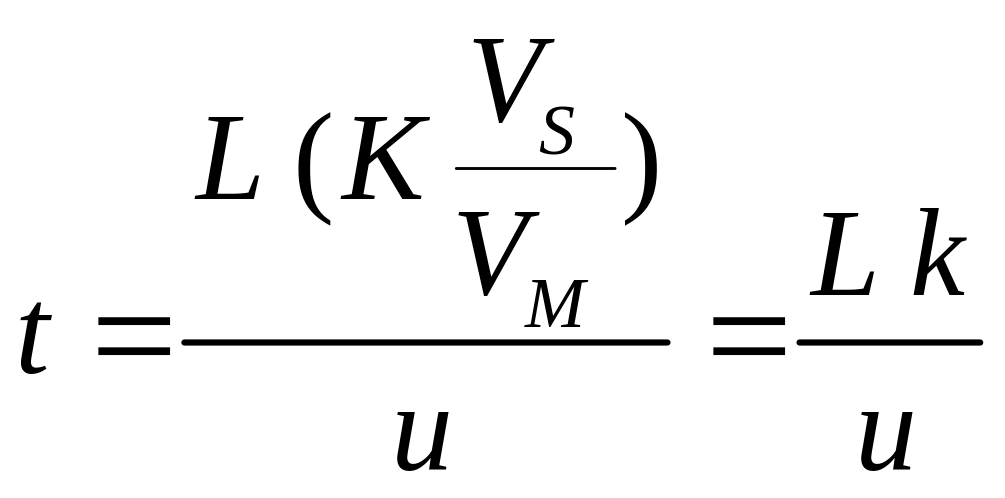 (4)
(4)
где k –фактор удерживания (фактор ёмкости), равный:
k = K (VS/ VM) (5)
Фактор удерживания можно определить непосредственно из хроматограммы:
k = (tR – to)/ to (6)
Характеристикой степени разделения двух веществ служит фактор разделения (коэффициент селективности) .
= t2/ t1= k2/k1 (7)
Этот коэффициент тоже можно определить непосредственно из хроматограммы.
