
- •Тема 1. Асептика в биотехнологических процессах.
- •Элементы асептики в биотехнологии
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах
- •Биохимические особенности роста микроорганизмов на углеродных субстратах
- •Стехиометрия процессов культивирования микроорганизмов
- •Формула биомассы микроорганизмов. Молекулярный вес биомассы (биомоль)
- •Экспериментальная часть
- •Подготовка посевного материала
- •Приготовление питательных сред
- •Построение калибровочного графика
- •Условия культивирования
- •Методы аналитических исследований
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
- •Описание кинетики ферментативных реакций
- •Описание кинетики микробного роста
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Примерные темы самостоятельных работ к семинарским занятиям
Описание кинетики микробного роста
В 40-х годах 20-го века Ж. Моно (Monod) показал, что достаточно удачным и универсальным для описания роста большинства микробных культур является уравнение, вид которого аналогичен уравнению Михаэлиса-Ментен, которое использовалось для фундаментального описания кинетики ферментативных реакций, в том числе внутри микробных клеток.
Таким образом, рост микроорганизмов зависит от питания (субстрата) и для большинства микроорганизмов описывается уравнением (моделью) Моно. Графическим образом уравнения Моно также является гипербола (рис. 3.3), а уравнение записывается с учетом лимитирующего действия субстрата на рост микроорганизмов:
μ = μmaxS/(Ks+S), (3.11)
где μmax– максимальная удельная скорость роста; при избытке субстрата μ = μmax (рис. 3.3);
Ks – константа полунасыщения (Моно); она является мерой усвояемости субстрата в процессе роста микроорганизмов. На рис. 3.3 наименьшее значение Ks отличает наиболее усвояемый субстрат (например, глюкозу); большее значение Ks’ может соответствовать менее усвояемому субстрату (например, галактозе), самое большое значение Ks’’ может характеризовать наименее усвояемый субстрат (например, янтарную кислоту).
µ,
ч-1
µmax
µmax/2







S, г/л
Ks
Ks’
KS’’
ΔS
Рис. 3.3 – Гипербола - графический образ уравнения Моно
Лимитирование микробного роста концентрацией субстрата наблюдается в следующем:
чем выше концентрация субстрата, тем больше удельная скорость роста (но не больше максимально возможной для данной микробной культуры и для данных условий культивирования). Следует также отметить, что существует диапазон минимальных концентраций субстрата ΔS, для которых не наблюдается микробный рост (рис. 3.3): энергии небольших количеств субстрата недостаточно для обеспечения конструктивного обмена и построения клеточной биомассы.
Аналогично, характерные зависимости для кинетики ферментативных реакций с ингибированием фермента относятся к специфике ингибирования микробного роста.
Кинетика ферментативных реакций с ингибированием фермента
Прежде всего, ингибирующее действие на ферменты микроорганизмов и, соответственно, на их рост может оказывать субстрат в высоких концентрациях. С учетом ингибирующего действия субстрата на фермент уравнение Михаэлиса-Ментен записывается следующим образом:
V = Vmax [S] / (Km + [S] +S2/Ki), (3.12)
где Ki – константа ингибирования субстратом.
Далее, кроме субстрата, не оказывающего ингибирующего действия, во взаимодействие с ферментом может вступать вещество-ингибитор, снижающее активность фермента и конкурирующее или неконкурирующее с субстратом за активные центры фермента.
При конкурентном ингибировании субстрат и ингибитор связываются с одним и тем же (!) активным центром фермента:
Вытеснение
ингибитора субстратом в насыщающей
концентрации

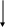




Поэтому в присутствии ингибитора снижается сродство фермента к субстрату (т.е. повышается значение Кm). Величина Vmax не изменяется, так как при «насыщающей» концентрации субстрат вытесняет ингибитор из комплекса с ферментом. В этом случае ингибирование имеет обратимый характер.
Для случая конкурентного ингибирования уравнение Михаэлиса-Ментен выглядит следующим образом:
V = Vmax [S] / (Km + [S] +[I]/Ki), (3.13)
где Ki = [E][I]/[EI] – константа ингибирования.
При неконкурентном ингибировании субстрат и ингибитор связываются с разными (!) активными центрами фермента.
k+1 k+2
E + S ES E + P
+ S ES E + P
k-1
k+3
E

 + I
EI
E
+ P
+ I
EI
E
+ P


 k-3
k-3
непродуктивный
комплекс
При этом величина Кm не изменяется, а величина Vmax снижается.
Уравнение Михаэлиса-Ментен с учетом неконкурентного ингибирования:
V = Vmax [S] / (Km + [S]) . 1/(1+[I]/Ki), (3.14)
Аналогично, фермент может подвергаться конкурентному или неконкурентному ингибированию продуктом реакции (Р):
При рассмотрении ингибирования ферментов следует отметить, что оно может быть обратимым или необратимым, когда активность фермента соответственно восстанавливается или не восстанавливается после удаления ингибитора из среды.
Ингибирование микробного роста, развития и размножения клеток
На уровне клеточного роста различают специфическое или неспецифическое (множественное) ингибирование со стороны компонентов окружающей среды.
Специфические ингибиторы, в первую очередь, антибиотики, приводят к гибели клеток вследствие избирательного ингибирования синтеза клеточных полимеров, а ингибиторы множественного неспецифического действия оказывают прямое губительное действие на микробные клетки.
Неспецифические ингибиторы роста оказывают многостороннее действие на обмен веществ. К ним, прежде всего, относятся тяжелые металлы. Их ингибирующее действие проявляется в инактивации ферментов. Они могут связываться с активным центром фермента, изменять конформацию молекулы фермента, вытеснять другие металлы, входящие в состав ферментов.
Степень токсичности тяжелых металлов совпадает со способностью их образовывать комплексы с функциональными группами веществ клетки и прочностью образуемых комплексов.
Тяжелые металлы ингибируют процесс дыхания, влияют на проницаемость и транспортный аппарат клетки.
Физиологическое состояние культуры дрожжей р. Candida
при воздействии на нее ингибитора
Ионы меди поступают в клетки р. Candida путем активного транспорта. Медь постоянно накапливается в клетках и обнаруживается в них с помощью электронного микроскопа в виде гранул, переходящих с периферии клетки в вакуоль. Вероятно, что гранулы, содержащие медь, имеют липидную природу. Клетки, ингибированные медью, могут длительное время существовать в хемостате.
Под действием ионов меди содержание основных полимеров в клетках р. Candida меняется: снижается содержание белка на 15 %, возрастает содержание липидов на 30 %. Видимо, медь ингибирует синтез белка и не затрагивает, а даже усиливает синтез резервных веществ.
Два типа реакции культур Candida utilis на ионы тяжелых металлов
Данные, полученные с ионами меди и серебра, приводят к выводу о том, что действие этих металлов на микроорганизмы принципиально различается как в условиях непродолжительного периодического культивирования (в острых опытах), так и при непрерывном культивировании (в хемостате).
Известно, что поглощение клетками ионов металлов может быть результатом следующих процессов: 1) адсорбции ингибитора клеточной поверхностью; 2) активного транспорта в клетку; 3) сложного процесса, когда первая фаза быстрой адсорбции сменяется активным транспортом. При адсорбции процесс протекает очень быстро, не зависит от температуры и физиологического состояния клеток. Активный транспорт протекает во времени и зависит от многих параметров.
Были исследованы процессы поглощения меди и серебра суспензиями С. utilis, отмытыми 0,l N раствором HCl. Клетки помещались в растворы CuSO4×5H2O или AgNO3, и определялась во времени убыль ионов из раствора и содержание металлов в клетках. Медь определялась полярографически, а серебро – на атомно-адсорбционном спектрофотометре (см. рис. 3.4).
Серебро практически мгновенно поглощалось как живыми, так и мертвыми клетками (гибель клеток вызывалась нагреванием при 80° С в течение 10 минут). При этом серебро легко вымывалось 0,l N раствором HCl. Процесс поглощения его не зависел от температуры в пределах от 4 до 37о С. Следовательно, в этом случае наблюдалась адсорбция ионов серебра.
Медь связывалась клетками постепенно, в течение двух часов. При этом все клетки оставались живыми. Процесс зависел от температуры, требовал энергетического субстрата и подавлялся ингибиторами энергетического метаболизма KCN и 1,4-ДНФ. Мертвые клетки связывали такое же количество меди мгновенно (рис. 3.4).

1 – живые клетки; 2 – мертвые
Рис. 3.4 - Сравнительное поглощение ионов серебра (а) и меди (б) клетками Candida utilis.
Лабораторная работа 3. Изучения влияния ингибиторов на рост микробной культуры методом острых опытов
Цель и задачи работы: получить комплекс экспериментальных данных, характеризующих влияние ингибиторов на рост экспоненциально растущей культуры и определить тип ингибирования, используя зависимость Лайнуивера-Берка (1/µ= f(1/S)).
Метод острых опытов изучает влияние ингибитора на поведение экспоненциально растущей культуры. Такого рода исследования позволяют выявить механизм ингибирования биосинтеза микробных полимеров и установить ингибирование синтеза конкретных биополимеров (белки микробной массы, липиды клетки, нуклеиновые кислоты и др.).
Для этого к экспоненциально растущей культуре добавляются различные дозы ингибитора и в течение 1,5-6 часов ведутся наблюдения за кинетикой роста в опыте и контроле.
Важно найти ту дозу (концентрацию) ингибитора, которая действует на наиболее чувствительное звено метаболизма (большие дозировки специфических ингибиторов могут действовать на несколько функций).
Также очень важна длительность опыта: чем она короче, тем точнее информация, т.к. повреждение одного звена метаболизма быстро отражается на многих других. Культивирование должно быть достаточно коротким для того, чтобы другие факторы среды, кроме добавленного ингибитора, не успели оказать своего действия.
Кроме того, в процессе исследований следят за выживаемостью неразмножающихся клеток в присутствии ингибитора.
Объекты исследования, оборудование, реактивы и посуда:
- посевной материал – суспензия дрожжей (р. Candida) 200-300 мл на полный эксперимент;
- перемешивающее устройство (качалка) – 2, 4, 6 шт.;
- весы – 2 шт.;
- фотоэлектроколориметр (2 шт.) и кюветы (на 5 мл);
- качалочные колбы (9 шт. на одну качалку) объемом 100 мл;
- питательная среда с раствором микроэлементов и витаминов;
- этанол как субстрат (S = 0,1 %; 0,3 %; 0,5 %);
- ингибитор – 1 % раствор CuSO4×5H2O;
- пипетки мерные объемом 10 мл – 6-8 шт.;
- пипетки мерные объемом 1 мл – 6-8 шт.;
- конические колбы объемом 250 мл – 6-8 шт.;
- пробирки со штативом (на 1 опыт, на 1 бригаду) – 5-6 шт.;
- мерные колбы объемом 50 или 100 мл – 4 шт.;
- мерные колбы объемом 500 мл – 2 шт.;
