
- •Тема 1. Асептика в биотехнологических процессах.
- •Элементы асептики в биотехнологии
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах
- •Биохимические особенности роста микроорганизмов на углеродных субстратах
- •Стехиометрия процессов культивирования микроорганизмов
- •Формула биомассы микроорганизмов. Молекулярный вес биомассы (биомоль)
- •Экспериментальная часть
- •Подготовка посевного материала
- •Приготовление питательных сред
- •Построение калибровочного графика
- •Условия культивирования
- •Методы аналитических исследований
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
- •Описание кинетики ферментативных реакций
- •Описание кинетики микробного роста
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Примерные темы самостоятельных работ к семинарским занятиям
Стехиометрия процессов культивирования микроорганизмов
Если в результате химического взаимодействия реагентов А и В образуются продукты С и D и выделяются тепло ∆Н, то можно с учетом стехиометрических коэффициентов νА, νВ, νC, νD и νН можно записать стехиометрическое уравнение реакции:
νАА + νВВ = νCС + νDD + νН ∆Н (2.6)
Определенные значения стехиометрических коэффициентов отражают закон сохранения материи: количество атомов элементов, составляющих вещества А,В,С и D, не должно изменяться в процессе превращения веществ.
Действие закона сохранения энергии в биологии приводит к перегруппировке макро- и микроэлементов. Такая перегруппировка предполагает, что общее количество углерода, азота, фосфора, водорода, кислорода, металлов и др. элементов, включенное в структурные компоненты клетки (ядро, клеточную стенку, митохондрии, др.), внутри- и внеклеточные вещества (АТФ, белки, липиды, нуклеиновые кислоты, эндо- и экзоферменты, антибиотики), равно количеству этих элементов, потребленных из питательной среды.
Схематическое представление процесса культивирования микроорганизмов представлено на рис. 2.3.
Субстраты
Продукты
Система
культивирования
микроорганизмов
Рис. 2.3 – Схема процесса культивирования микроорганизмов
Стехиометрическое уравнение для ферментативной реакции превращения субстратов (S) в продукты (Р) и биомассу (Х) в процессе культивирования можно записать следующим образом (квадратные скобки традиционно обозначают концентрации веществ, в данном случае различных субстратов):
νС [углеродный субстрат] + νN [азотный субстрат] + νФ [фосфорный субстрат] + νО2 [кислород как субстрат] =
νХ [биомасса] + νР [продукт метаболизма] + …+ νСО2 [СО2] + νН2О [Н2О] + νН ∆ Н (2.7)
В процессах культивирования биомасса (Х) накапливается как продукт реакции; она же в качестве инокулята является важнейшим исходным реагентом, от ферментативной (катализирующей) активности которого зависит протекание реакции. Поэтому правильнее было бы показать биомассу в качестве субстрата с коэффициентом νХ , а в качестве продукта с коэффициентом (νХ+1). Однако количество инокулята принимается пренебрежимо малым в сравнении с количеством биомассы, накопленной в процессе культивирования.
Реакции, в которых продукт является катализатором реакции, называются автокаталитическими.
Формула биомассы микроорганизмов. Молекулярный вес биомассы (биомоль)
Для работы со стехиометрическим уравнением нужно определить формулу биомассы. Элементный состав биомассы микроорганизмов приведен в табл. 2.1.
Таблица 2.1 – Элементный состав биомассы различных микроорганизмов
Состав микроорганизмов |
Элементный состав, % |
||||||
С |
Н |
О |
N |
P |
S |
Зола |
|
Дрожжи |
47,0 |
6,5 |
30,0 |
7,5 |
1,5 |
1,0 |
6,5 |
Бактерии |
53,0 |
7,0 |
20,0 |
12,0 |
3,0 |
1,0 |
4,0 |
«Усредненный» |
50,0 |
8,0 |
20,0 |
14,0 |
3,0 |
1,0 |
4,0 |
Если принять сухой вес биомассы равным 100 г, масса соответствующего элемента (С, H, O, N, P, S) в граммах (грамм-атомах) равна отношению его процентного содержания к его атомной массе (табл. 2.2). При этом зольными компонентами биомассы пренебрегают.
Таблица 2.2 – Удельно-весовой элементный состав биомассы различных микроорганизмов
Состав микроорганизмов |
Элементный состав, грамм-атомов |
|||||
С/12 |
Н/1 |
О/16 |
N/14 |
P/31 |
S/32 |
|
Дрожжи |
3,92 |
6,5 |
1,88 |
0,54 |
0,05 |
0,03 |
Бактерии |
4,42 |
7,0 |
1,25 |
0,86 |
0,1 |
0,03 |
«Усредненный» |
4,17 |
8,0 |
1,25 |
1,0 |
0,1 |
0,03 |
Таким образом, формула биомассы записывается так:
для дрожжей C3,92H6,5O1,88N0,54P0,05S0,03 ,
для бактерий: C4,42H7,0O1,25N0,86P0,1S0,03 ,
для микроорганизмов «усредненного» состава: C4,17H8,0O1,25N1,0P0,1S0,03 .
Молекулярный вес биомассы (биомоль) составляет около 100 (с учетом зольности биомассы).
Для простоты расчетов по стехиометрическим уравнениям из формулы биомассы можно исключить некоторые элементы, чаще всего фосфор и серу.
Далее, для расчетов удобнее принять формулу биомассы из расчета на 1 атом углерода. Для этого нужно разделить индексы при всех атомах на индекс при углероде:
для дрожжей – CH1,66O0,48N0,14
для бактерий – CH1,58O0,28N0,19
для биомассы «усредненного» состава - CH1,92O0,3N0,24
Для практических расчетов биомоля «усредненного» состава часто используют формулу Стоутхамера:
CH1,8O0,5N0,2 с молекулярной массой 24,6.
Лабораторная работа 2. Кинетика и стехиометрия роста микроорганизмов
Цели и задачи работы: получить экспериментальные данные, характеризующие периодический процесс роста дрожжей на конкретном углеродном субстрате (глюкоза, этанол, глюкозо-спиртовая смесь (1:1)) и провести их анализ.
Периодическое культивирование микроорганизмов представляет с точки зрения техники наиболее простой метод культивирования. В этом случае в качалочную колбу или ферментатор помещается питательная среда, в которую вносится активная культура микроорганизмов – инокулят (от лат. inoculatio - прививка). Инокулят иначе называют посевным материалом, а инокуляцию называют посевом. В дальнейшем наблюдают за ростом и накоплением микроорганизмов в питательной среде.
Рост микроорганизмов наблюдается до тех пор, пока концентрации питательных компонентов не станут лимитирующими, или пока в культуральной жидкости концентрация продуктов метаболизма не достигнет критического уровня, подавляющего (ингибирующего) микроорганизмы. Культуральная жидкость представляет собой жидкую фазу по окончании культивирования микроорганизмов, содержащую продукты ферментации, биомассу и/или ферменты, неиспользованный субстрат и другие компоненты питательной среды.
Под культивированием микроорганизмов понимают их выращивание в наиболее благоприятных (оптимальных) условиях (от этого ключевого понятия возникают определение культуры микроорганизмов, культуральной жидкости и т.п.).
Для феноменологического описания роста микроорганизмов в периодическом режиме обычно используют кривую роста (рис. 2.4). Она имеет S-образный характер. Различают несколько стадий роста.

lg N
I II III IV V VI
τ
Рис. 2.4 – Кривая роста периодической культуры микроорганизмов
Сразу после посева (инокуляции) наблюдается лаг-фаза (I). В этой фазе число клеток не возрастает, однако идут интенсивные приспособительные процессы. После окончания лаг-фазы скорость роста возрастает. Эта фаза носит название фазы ускорения роста (II) и занимает весьма небольшое время. Экспоненциальная (логарифмическая) фаза (III) характеризуется постоянной максимальной скоростью деления клеток. Логарифмическая фаза роста сменяется фазой замедления роста (IV), когда наблюдается еще относительно интенсивный рост клеток, однако скорость роста замедляется. За ней у многих микроорганизмов наступает стационарная фаза (V), когда концентрация биомассы не меняется во времени. Далее следует фаза отмирания и выживания (VI), в ходе которой число жизнеспособных клеток снижается.
Количественное описание роста микроорганизмов осуществляется c помощью удельной скорости роста.
В каждый момент
времени µ =
![]() , (2.8)
, (2.8)
где µ – удельная скорость роста, ч -1;
х – концентрация биомассы в момент времени τ.
Интегрирование этой зависимости дает возможность определить удельную скорость роста за определенные промежутки времени
µср
=
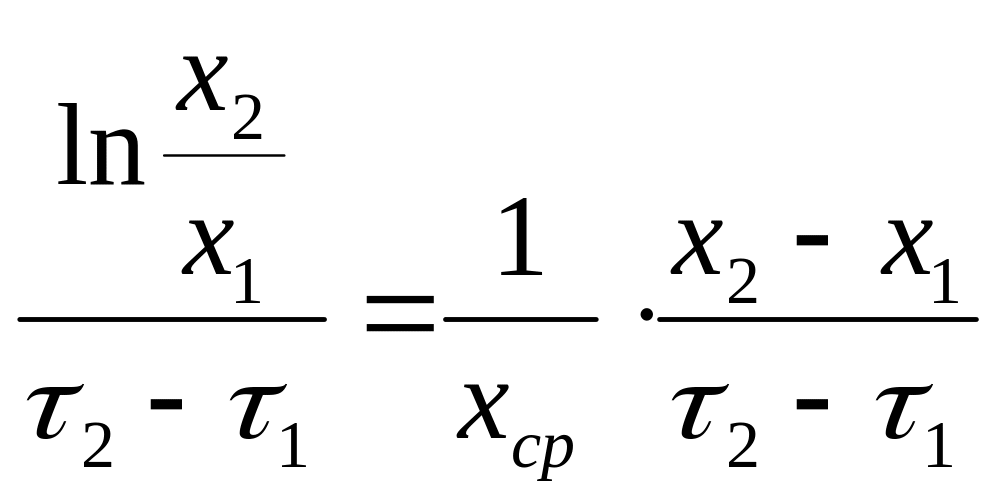 , (2.9)
, (2.9)
где х1 и х2 – концентрация биомассы в начальный и конечный момент времени;
хср – средняя концентрация биомассы.
Изменение в процессе ферментации метаболического коэффициента q, дает возможность судить о кинетике потребления субстрата
q
=
![]() , (2.10)
, (2.10)
где S1 и S2 – концентрация субстрата в момент времени τ1 и τ2.
В общем случае он характеризует долю субстрата, используемого для роста определенного количества биомассы за определенный промежуток времени. Надо отметить, что метаболический коэффициент может быть рассчитан для любого субстрата: органического (этанол и др.), минерального (азот, фосфор, и т.д.).
Рассмотренные показатели µ и q представляют кинетические характеристики роста культуры. Однако при целостном рассмотрении процесса, важное значение имеют стехиометрические показатели – выходы по массе и энергии.
Под выходом по массе (или экономическим коэффициентом) понимается весовое отношение прироста абсолютно сухой биомассы (АСБ) к потребленному субстрату (г АСБ/г субстрата)
Y = ∆х/∆S (2.11)
Однако этот показатель имеет существенный недостаток: массовый выход не характеризует эффективность процесса роста с точки зрения энергии. Так при росте микроорганизмов на глюкозе и уксусной кислоте могут быть получены одинаковые значения Y, хотя энергия, содержащаяся в этих соединениях различна. Энергетический выход η характеризует долю энергии субстрата, перешедшую в биомассу. Универсальной единицей восстановленности является редоксон. Количество редоксонов в расчете на грамм-атом углерода характеризует восстановленность вещества γ. Для вещества состава CHpOnNq она рассчитывается по формуле
γ = 4 + р – 2n – 3q (2.12)
Связь энергетического выхода и выхода по массе имеет вид
![]() , (2.13)
, (2.13)
где σв, σs – весовая доля углерода в биомассе и субстрате соответственно;
γв, γs – степень восстановленности биомассы и субстрата.
Степень восстановленности углерода в биомассе мало меняется в зависимости от вида микроорганизма и равна γв = 4,2. Средняя весовая доля углерода в биомассе σв = 0,46.
Приведем уравнение
количественной связи энергетического
выхода и выхода по кислороду Y![]() :
:
Y
= 0,75
![]() (2.14)
(2.14)
При выращивании дрожжей на этаноле в качестве конечного продукта получают микробную биомассу – продуцент белка. В практическом отношении представляет интерес значение выхода белка из потребленного субстрата
Y
X/S
=
![]() , (2.15)
, (2.15)
где: Б – содержание белка, % вес.;
Sо, S – начальная и конечная концентрация субстрата г/л, соответственно.
Объекты исследования, оборудование, реактивы и посуда:
- музейная культура дрожжей – 2-3 пробирки;
- суспензия дрожжей (р. Candida или р. Saccharomyces) – 20-50 мл;
- микроскопы – 5 шт.;
- газовый хроматограф;
- спектрофотометр;
- фотоэлектроколориметр – 2 шт. и кюветы на 5 мл;
- центрифуга (8000 мин-1);
- водяная баня – 2 шт.;
- электроплитка – 2 шт.;
- весы – 2 шт.;
- перемешивающее устройство (качалка) – 2 шт.;
- качалочные колбы (9 шт. на одну качалку) объемом 100 мл;
- NH4H2PO4 – 50-100 г;
- (NH4)2SO4 – 5-10 г;
- MgSO4 . 7 H2O – 7-10 г;
- Na2HPO4·12H2O – 7-10 г;
- KH2PO4 – 30-40 г;
- K2HPO4 – 1 г;
- FeSO4 – 10-20 г;
- MnSO4 – 10-20 г;
- ZnSO4 – 10-20 г;
- NaCl – 5-10 г;
- СаCl2 × 4 H2O – 1 г
- H2SO4 (конц.) – 100 мл;
- этанол как субстрат – 20-50 мл;
- глюкоза как субстрат 20-50 г
- дрожжевой автолизат – 20-50 мл;
- K2Cr2O7 – 50-100 г;
- раствор соли Мора FeSO4×(NH4)2SO4 – 92 г и H2SO4 в 1 л Н2О;
- раствор феррицианида K3Fe(CN)6 – 0,2 г/л;
- 0,5 н раствор NаОН – 500 мл;
- физиологический раствор (0,85 г NaCl на 10 мл Н2О);
- раствор Люголя;
- медный купорос, оксид меди СuSO4 × 5H2O – 35 г;
- сегнетова соль COOK-CHOH-CHOH-COONa× 4H2O – 175 г;
- 40% раствор KJ;
- 0,1 н раствор гипосульфита натрия Na2S2O3;
- 0,5% раствор крахмала;
- пипетки мерные объемом 1 мл – 5-10 шт.;
- пипетки мерные объемом 2 мл – 5-10 шт.;
- конические колбы объемом 250 мл – 5 шт.;
- пробирки со штативом (на 1 опыт, на 1 бригаду) – 8-10 шт.;
- мерные колбы объемом 50 или 100 мл (на бригаду) – 4-5 шт.;
- мерные колбы объемом 500 мл (1000 мл) – 2 шт.;
- бюретки объемом на 50 мл (100 мл) – 2 шт.;
- круглодонная колба с резиновой пробкой и газоотводной трубкой объемом 50-75 мл – 1-2 шт.;
- трехшариковая колба (приемная) – 1-2 шт.;
- предметные стекла – 10 шт.;
- покровные стекла – 10 шт.;
- марлевые салфетки;
- фильтровальная бумага.
