
- •Тема 1. Асептика в биотехнологических процессах.
- •Элементы асептики в биотехнологии
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах
- •Биохимические особенности роста микроорганизмов на углеродных субстратах
- •Стехиометрия процессов культивирования микроорганизмов
- •Формула биомассы микроорганизмов. Молекулярный вес биомассы (биомоль)
- •Экспериментальная часть
- •Подготовка посевного материала
- •Приготовление питательных сред
- •Построение калибровочного графика
- •Условия культивирования
- •Методы аналитических исследований
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
- •Описание кинетики ферментативных реакций
- •Описание кинетики микробного роста
- •Экспериментальная часть
- •Расчетная часть
- •Контрольные вопросы
- •Литература
- •Примерные темы самостоятельных работ к семинарским занятиям
Федеральное агентство по образованию
Казанский государственный технологический университет
А.С. Сироткин, В.Б. Жукова
Теоретические основы биотехнологии
Учебно-методическое пособие

М етодические
разработки
етодические
разработки
кафедры промышленной
биотехнологии
Казань, 2009
УДК 577.15:663/664(075.8)
Теоретические основы биотехнологии: Учебно-методическое пособие /А.С. Сироткин, В.Б. Жукова; Казан. гос. технол. ун-т, Казань, 2009. 50 с .
Учебно-методическое пособие по дисциплине «Теоретические основы биотехнологии» предназначено для студентов, обучающихся по специальности 24090165 – Биотехнология, а также по направлению подготовки бакалавров и магистров 550800 – Химическая технология и биотехнология.
Пособие содержит теоретические сведения из соответствующего лекционного курса, читаемого на кафедре промышленной биотехнологии по очной и очно-заочной формам обучения. Лекционный материал поддерживает осознанное выполнение заданий к лабораторным работам, а также помогает студентам успешно подготовиться к сдаче коллоквиумов по тематическим разделам учебной дисциплины, итоговых зачета и экзамена.
В части лабораторного практикума изучаются кинетические закономерности гибели микроорганизмов в процессе термического воздействия на микробные суспензии; роста микробных популяций на различных субстратах и рассматриваются аналитические методы определения параметров процесса культивирования клеток; исследуется влияние ингибиторов на рост микроорганизмов при различных способах культивирования.
В оформлении методического пособия принимала участие ведущий программист И.П. Мужиковская.
П одготовлено
на кафедре промышленной биотехнологии.
одготовлено
на кафедре промышленной биотехнологии.
Табл. 8, Ил. 10. Библиогр. 24 ист.
Печатается по решению редакционно-издательского совета Казанского государственного технологического университета.
Рецензенты: |
заведующий кафедрой «Водные ресурсы и аквакультура» Казанского государственного энергетического университета, д.б.н., профессор М.Л. Калайда
профессор кафедры технологии пищевых производств Казанского государственного технологического университета, д.б.н., профессор Ежкова Г.О.
|
© Казанский государственный технологический университет, 2009 г.
Оглавление
Введение |
4 |
Тема 1. Асептика в биотехнологических процессах. Стерилизация оборудования, питательных сред и воздуха Лабораторная работа 1. Изучение кинетики гибели микроорганизмов Контрольные вопросы Литература |
5 11 17 17 |
Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах Лабораторная работа 2. Кинетика и стехиометрия роста микроорганизмов Контрольные вопросы Литература |
18 25 36 36 |
Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования Лабораторная работа 3. Изучение влияния ингибиторов на рост микробной культуры методом острых опытов Контрольные вопросы Литература |
37
44 48 48 |
Примерные темы самостоятельных работ к семинарским занятиям |
49 |
Введение
В настоящий момент вряд ли у кого-нибудь может возникнуть сомнение в том, что современная биология представляет собой наиболее разнообразную область естественных наук. Действительно, она включает казалось бы совершенно не связанные между собой разделы научных знаний: микробиологию, анатомию растений и животных, биохимию, иммунологию, клеточную биологию, физиологию растений и животных, различные систематики, экологию, генетику, биофизику, математику и много других областей естествознания.
Именно существенные успехи в фундаментальных исследованиях в области биохимии, молекулярной генетики и молекулярной биологии, достигнутые во второй половине текущего столетия, создали реальные предпосылки управления различными (пусть, возможно и не самыми главными) механизмами жизнедеятельности клетки. Сложившаяся благоприятная ситуация в биологии явилась мощным толчком в развитии современной биотехнологии, весьма важной области практического приложения результатов фундаментальных наук.
Можно с уверенностью утверждать, что биотехнология является наиболее разительным примером того, как результаты, казалось бы "чистой науки", находят применение в практической деятельности человека. Основой, обеспечивающей благоприятную ситуацию для бурного развития биотехнологии, явились революционизирующие открытия и разработки:
• доказательства роли нуклеиновых кислот в хранении и передаче наследственной информации в биологических системах (имеются в виду индивидуальные клетки и отдельные организмы, а не их популяции);
• расшифровка универсального для всех живых организмов генетического кода;
• раскрытие механизмов регуляции функционирования генов в процессе жизни одного поколения организмов;
• совершенствование существовавших и разработка новых технологий культивирования микроорганизмов, клеток растений и животных;
• как логическое следствие из вышесказанного, явилось создание (возникновение) и бурное развитие методов генетической и клеточной инженерии, с помощью которых искусственно создаются новые высокопродуктивные формы организмов, пригодные для использования в промышленных масштабах.
Все эти достижения вывели биотехнологию на новый уровень ее развития, позволяющий сознательно и целенаправленно управлять сложными клеточными процессами. Данная новая область биологических знаний и ее последние достижения стали крайне важными для здоровья и благополучия человека.
Тема 1. Асептика в биотехнологических процессах.
Стерилизация оборудования, питательных сред и воздуха
Асептика (от греческого a – не, нет, sepsis – гниение) – это комплекс мероприятий, направленных на предотвращение попадания в среду (объект) посторонних микроорганизмов, включая болезнетворные (патогенные). Следовательно, асептика в биотехнологии и в медицине, например, в хирургической практике – это не одно и то же понятие. В биотехнологии предполагают использование какого-либо биообъекта (в том числе микробного) и полное исключение попадания других микроорганизмов, являющихся посторонними. В медицине стремятся исключить любую возможность попадания патогенных микробов и микробов-контаминантов (от латинского contamination – загрязнение) на операционное поле или рану.
Каждый из материальных потоков в биотехнологических процессах – потенциальный источник микробов-контаминантов.
Асептика может включать влажную уборку помещений, обработку их ультрафиолетовыми лучами, антисептическими средствами, использование стерильных инструментов, сред, технологической одежды, подачу стерильного воздуха (столы с ламинарным потоком стерильного воздуха в специальных асептических помещениях (микробиологических боксах), поступление в ферментатор стерильного воздуха через барботёр (от фрацузского barbotage – перемешивание) и пр.
Следовательно, комплекс мер, обеспечивающих асептику биотехнологических процессов включает: механическую, физическую и химическую защиту биообъекта и среды его обитания, а при необходимости и конечный продукт. К механической защите относятся: удаление механических примесей (например, из воздуха) герметизация оборудования, изоляция узлов и соединений; к физической – обработка воздуха и поверхностей приборов ультрафиолетовыми лучами, кипячение, стерилизация паром под давлением, обработка ультразвуком; к химической – обработка поверхностей химическими антисептиками.
Элементы асептики в биотехнологии
Стерилизация – обеспложивание, т.е. полное уничтожение вегетативных форм микроорганизмов и их спор в различных материалах. Стерилизацию проводят физическими и химическими методами.
К физическим методам относятся:
воздействие высокой температуры;
ультрафиолетовое облучение;
стерилизующая фильтрация.
I. Физические методы стерилизации.
1. Прокаливание в пламени спиртовки или газовой горелки. Данный способ применяется ограниченно, например, для стерилизации бактериологических петель, препаровальных игл, пинцетов и других сопутствующих материалов.
2. Стерилизация кипячением. Этим методом стерилизуют мелкий инструментарий, предметные и покровные стекла и некоторые другие предметы. Их помещают в стерилизаторы, в которые наливают воду. Для устранения жесткости и повышения температуры кипения к воде добавляют 1-2 % раствор бикарбоната натрия. Кипячение производят не менее 30 минут. Однако данный метод не обеспечивает полной стерилизации, так как некоторые вирусы (например, вирус гепатита) и споры бактерий могут остаться жизнеспособными.
3. Стерилизация сухим жаром, или суховоздушная стерилизация в сушильном шкафу (печи Пастера). Метод основан на бактерицидном действии нагретого до 165-180о С воздуха. При более высокой температуре происходит обугливание ватных пробок, бумаги, в которую завернута посуда, а при более низкой температуре требуется больший срок стерилизации. Сухим жаром стерилизуют стеклянную посуду: чашки Петри, пробирки, пипетки и др.
4. Стерилизация паром, под давлением в автоклаве. Один из наиболее эффективных методов стерилизации, который широко применяется в микробиологической практике. Работа с автоклавом требует точного выполнения специальной инструкции и соблюдения правил безопасности. Многие питательные среды, материалы стерилизуют при давлении 1 атм. в течение 10-20 минут, питательные среды с углеводами – при 0,5 атм. в течение 15 минут, а обеззараживание инфицированного материала производят при 1,5-2 атм. в течение 20-25 минут (табл. 1.1).
Таблица 1.1 – Соотношение между давлением, температурой и продолжительностью стерилизации в автоклаве
Давление пара, атм. |
Температура, оС |
Время стерилизации, мин. |
0 |
100 |
30-60 (дробно) |
0,5 |
111 |
20-30 |
1 |
121 |
15-20 |
1,5 |
127 |
15-20 |
2 |
133 |
15 |
5. Стерилизация текучим паром в аппарате Коха или в автоклаве. Данный вид стерилизации (при незавинченной крышке и открытом выпускном кране) основан на антибактериальном действии пара в отношении вегетативных клеток. Он применяется в тех случаях, когда стерилизуемый материал не выдерживает высокой температуры, например, питательные среды с витаминами, углеводами.
6. Дробная стерилизация. Применяется для стерилизации легко разрушающихся при высокой температуре веществ (сыворотка крови, витамины и др.). Обеспечивает полное обеспложивание питательных сред и других материалов при 100о С (или 80-90о С) в течение 20-30 минут 3 дня подряд. При этом вегетативные клетки погибают, а споры сохраняются и за сутки прорастают. Последующее двукратное прогревание обеспечивает достаточно надежную стерильность материала. К процессам дробной стерилизации относится тиндализация, предполагающая термическую обработку материалов при 56-58о С в течение часа 5-6 дней подряд.
7. Пастеризация. Данный метод основан на антибактериальном действии температуры в отношении вегетативных клеток, но не бактериальных спор. Нагревание материала производится при температуре 50-65о С в течение 15-30 минут или 70-80о С в течение 5-10 минут с последующим быстрым охлаждением. Обычно пастеризуют напитки и пищевые продукты (вино, пиво, соки, молоко и др.).
8. Стерилизация ультрафиолетовыми лучами. Для полной или частичной стерилизации применяют ультрафиолетовые, рентгеновские и γ‑лучи. В спектре ультрафиолетовых ламп преобладает излучение в области 260 нм, поглощаемое, главным образом, нуклеиновыми кислотами и при достаточно долгом воздействии вызывающее гибель всех бактерий. В спектре ртутной лампы максимальное стерилизационное действие оказывает сильная полоса испускания 254 нм (рис. 1.1).
Ультрафиолетовые лучи используются для частичной стерилизации помещений, при этом бактерии погибают быстро, а споры грибов, менее чувствительные к ультрафиолетовому воздействию, значительно медленнее.
Ионизирующее излучение применяют для стерилизации пищевых продуктов.

Рис. 1.1 – Воздействие УФ лучей на микроорганизмы
9. Стерилизующая фильтрация.
Этот метод обеспечивает полное или частичное задержание микроорганизмов. Он широко применяется для очистки газов (аэрирующего воздуха) и жидкостей (главным образом, на конечных стадиях производства фармацевтических препаратов).
Возможны два механизма задержания частиц при фильтрации.
Первый из них – прямой перехват, то есть задержание частиц, размер которых больше максимального размера пор фильтра. Очевидно, эффективность фильтра по задержанию таких частиц составит 100 %. Однако прямым перехватом задерживается значительная часть частиц меньшего размера в результате их улавливания в более мелких порах, так как в большинстве фильтрующих материалов имеются поры разных размеров, а также путем одновременного попадания двух мелких частиц в одно отверстие и т. п. Следует отметить, что для удаления из газов столь мелких частиц, как бактерии (минимальный размер 0,3-0,4 мкм), фильтры, работающие на принципе простого перехвата, используются сравнительно редко, поскольку имеют очень высокое гидравлическое сопротивление из-за малого размера пор. При стерилизующей фильтрации жидкостей прямой перехват является основным механизмом задержания частиц.
Второй механизм – задержание при соударении частиц с волокнами фильтра. Наряду с частицами, размер которых больше размера пор, фильтры для очистки газов способны удерживать частицы значительно меньшего размера. Это обусловлено тем, что при соударении твердой частицы с волокном фильтрующего материала она «прилипает» к ней и удерживается ван-дер-ваальсовыми силами. Поскольку эти силы быстро уменьшаются с увеличением радиуса частицы, они удерживают лишь мелкие частицы, размер которых не превышает 2-10 мкм.
Соударение твердых частиц с волокнами может происходить по двум причинам. При огибании волокна потоком газа твердые частицы сравнительно большого размера (более 0,5 мкм) продолжают двигаться по инерции прямолинейно вследствие значительной разницы в плотностях частицы и окружающего ее газа и наталкиваются на волокно. Более мелкие частицы увлекаются воздушным потоком и гораздо реже наталкиваются на волокна. А для самых мелких частиц твердой фазы (менее 0,1-0,2 мкм) существенную роль играет броуновское движение, благодаря которому вероятность соударения частицы с волокном увеличивается.
Таким образом, наиболее трудно улавливаются частицы размером от 0,2 до 0,5 мкм.
Для повышения эффективности фильтрата, работающего по принципу задержания частиц при соударениях, увеличивают толщину слоя фильтрующего материала. Например, если степень улавливания фильтром частиц определенного размера составляет 90 %, то увеличение толщины слоя фильтра вдвое приведет к повышению этой цифры до 99 % и т. д. Так можно добиться почти 100 % -ного улавливания твердых частиц определенного размера, используя фильтр с порами гораздо большего размера, но достаточной толщины. Напомним еще раз, что это относится только к фильтрующей стерилизации газов; при фильтрации жидкостей основной механизм улавливания – прямой перехват. Любой фильтр можно охарактеризовать максимальным размером пор (улавливание частиц большего размера в нем абсолютное), а также зависимостью удерживающей способности фильтра от размера частиц меньше диаметра пор при определенном режиме фильтрации.
Фильтры для тонкой и стерилизующей фильтрации подразделяют на поверхностные и глубинные. К поверхностным относятся плетеные сетчатые фильтры, а также мембраны, имеющие прямые сквозные отверстия. В фильтрах этого типа частицы удерживаются в основном на поверхности фильтра, что приводит к быстрому забиванию пор и прекращению фильтрации. Такие фильтры можно использовать для обработки предварительно очищенных от большей части загрязнений жидкостей и газов.
Фильтры глубинного типа, в которых задержание частиц происходит по всему объему материала, имеют хаотически расположенные поры. Их в свою очередь можно разделить на фильтры, поры которых не увеличиваются при возрастании давления (мембранные фильтры), и у которых поры увеличиваются при увеличении давления (например, фильтры с набивкой из хлопчатобумажных нитей). Фильтры с увеличением пор имеют низкие эксплуатационные характеристики и плохо удерживают частицы в условиях пульсации давления.
Особенность процесса стерилизующей фильтрации в биотехнологических производствах состоит в том, что здесь требуется полное задержание бактерий, представляющих собой очень мелкие частицы (самые мелкие бактерии имеют размер 0,3 мкм). Это обусловливает необходимость использования многостадийных систем очистки с применением разных типов фильтров на различных стадиях.
При разделении биологических суспензий, т.е. при отделении клеток микроорганизмов, а также частиц – вирусов, мелкодисперсных и коллоидных примесей, макромолекул (белков, ферментов, нуклеиновых кислот) от культуральной жидкости используются следующие методы фильтрации:
1) собственно фильтрация через тканевые фильтры – для отделения частиц размером от 10 мкм до 1 мм (мелкодисперсных примесей, развитого мицелия грибов). Мицелиальные грибы имеют размеры микроколоний до 1 мм, что упрощает их отделение от жидкости. Кроме того, в жидкой фазе могут присутствовать нерастворимые компоненты питательной среды, как, например, мука, дробина, применяемые в спиртовом производстве. Тонкие взвеси этих компонентов имеют размеры от 10 до 100 мкм, а грубые взвеси – от 100 мкм до 1 мм;
2) микрофильтрация – для отделения частиц размеров от 200 нм до 10 мкм (мицелия грибов, крупных клеток дрожжей, эритроцитов). Наиболее крупные клетки дрожжей имеют размеры до 15-20 мкм;
3) ультрафильтрация – для отделения частиц размером от 10 нм до 5 мкм (клеток дрожжей, бактерий, некоторых вирусов, макромолекул). Этим методом могут успешно отделяться клетки дрожжей, размеры которых составляют от 3 до 5 мкм; бактериальные клетки, имеющие размеры от 0,3 до 1 мкм, вирусы с размером больше 10 нм, а также ферменты, нуклеинов кислоты и другие макромолекулы размером от 10 до 120 нм.
II. Химическая стерилизация – основана на применении различных химических соединений: окись этилена, β-пропиолактон, растворы хлорамина, карболовой кислоты, фенола, 70 % раствора этанола и др. Этот метод чаще всего используется для стерилизации поверхностей, посуды, инструментов, удаления микроорганизмов из отработанных питательных сред.
Химические средства:
1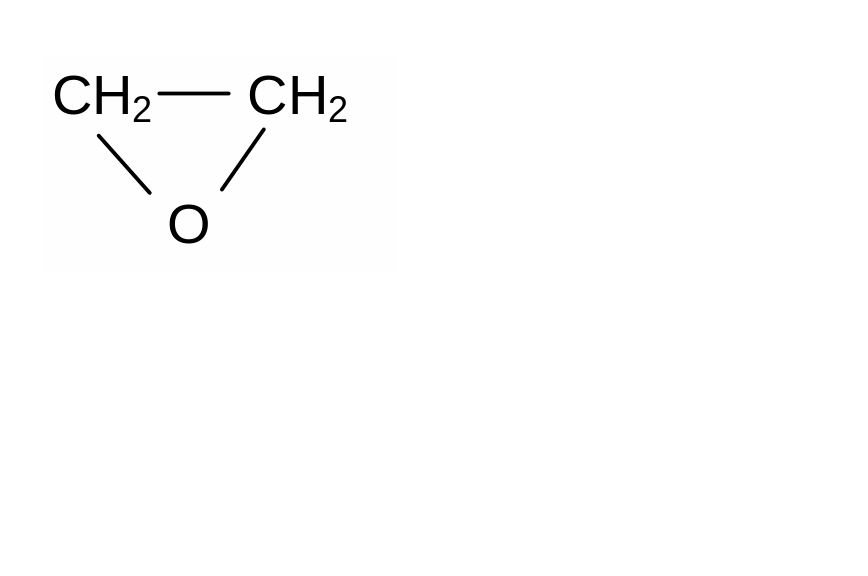 .
Этиленоксид (окись этилена) – вызывает
гибель вегетативных клеток и спор, но
действует только в том случае, если
подвергаемые стерилизации материалы
содержат некоторое количество воды
(5-15 %). Окись этилена применяют в виде
газовой смеси (с N2
или СО2),
в которой ее доля составляет от 2 до 50
%.
.
Этиленоксид (окись этилена) – вызывает
гибель вегетативных клеток и спор, но
действует только в том случае, если
подвергаемые стерилизации материалы
содержат некоторое количество воды
(5-15 %). Окись этилена применяют в виде
газовой смеси (с N2
или СО2),
в которой ее доля составляет от 2 до 50
%.
2. β-пропиолактон
– применяют для стерилизации питательных
сред, содержащих в своем составе
термолабильные вещества. Его раствор
(0,1-1 %) а ктивнее
окиси этилена, необратимо инактивирует
клетки и споры. Далее β‑пропиолактон
произвольно гидролизуется до карбоновых
кислот, являющихся дополнительным
субстратом.
ктивнее
окиси этилена, необратимо инактивирует
клетки и споры. Далее β‑пропиолактон
произвольно гидролизуется до карбоновых
кислот, являющихся дополнительным
субстратом.
3. Диэтилпирокарбонат
(0,003-0,02 %) – применяют для стерилизации
н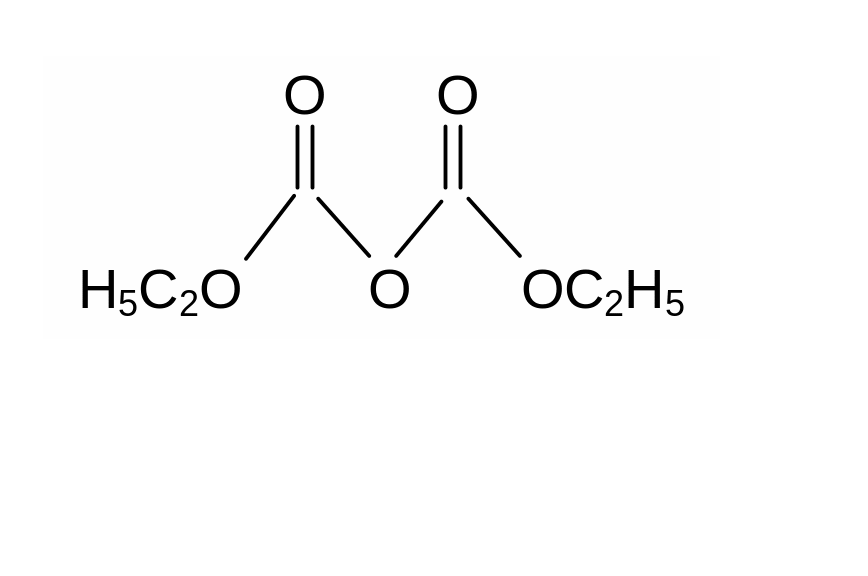 апитков
(вино, фруктовые соки).
апитков
(вино, фруктовые соки).
4. Растворы хлорамина (0,5-10 %) – используются чаще всего для стерилизации посуды, инструментов и поверхностей.
Основные методы стерилизации представлены в таблице 1.2.
Таблица 1.2 – Методы стерилизации оборудования, питательных сред и воздуха
Метод |
Краткая характеристика |
Область применения |
Термообработка: |
Нагревание объекта стерилизации на время, достаточное для гибели всей микробной популяции |
Основной метод стерилизации биореакторов, питательных сред и добавок, вспомогатель-ного оборудования и фильтров для стерилизации воздуха |
острым паром |
Подача струи пара под высоким давлением в аппарат с питатель-ной средой с помощью барботёра или парового инжектора |
Стерилизация аппаратов и сред |
глухим паром |
Пар изолирован от стерилизуе-мых сред металлическими стенками (например, пар пропускают по змеевику) |
Стерилизация некоторых питательных сред или их компонентов (например, масел) |
паром, генерируемым в самом сосуде, подлежащем стерилизации |
Используют электронагреватели, вводимые в стерилизуемый объект |
Стерилизация биореакторов и сред, если последние не пригорают к нагревателю |
в автоклаве |
Стерилизуемые материалы вносят в автоклав – аппарат, где вода доводится до кипения при повышенном давлении |
Стерилизация некоторых лабораторных биореакторов, небольших объемов жидкости, мелких элементов вспомога-тельного оборудования |
Дезинфекция (химическое воздействие) |
Применяют химические дезинфицирующие агенты (β‑пропиолактон, окись этилена, окись пропилена), самопроизвольно разлагающиеся в воде без образования токсических продуктов |
Стерилизация питательных сред, в основном для лабораторных биореакторов |
Фильтрационный |
Пропускание газов / жидкостей через мелкопористые или волокнистые фильтры, задерживающие микроорганизмы |
Стерилизация поступающего в биореактор воздуха / газа, в меньшей степени используют как мягкий метод стерилизации жидких сред без взвесей |
Радиационный |
Обработка ультрафиолетовым и радиоактивным излучениями |
Не получил распространения |
Ультразвуковое воздействие |
Обработка ультразвуком жидких сред с определенным подбором частот 22-44 кГц |
Экспериментальный метод, рекомендован для широкого промышленного применения |
Лабораторная работа 1. Изучение кинетики гибели микроорганизмов
Цель и задачи работы: определить основные показатели, которые характеризуют эффективность термической стерилизации и обеспечивают заданную степень асептики.
Гибель части клеток в процессе роста популяции учитывается большинством моделей как процесс, протекающий параллельно и независимо от размножения жизнеспособных особей той же культуры.
В ряде случаев, а именно при стерилизации жидких и твердых сред, оборудования, вспомогательных материалов, гибель части или всех клеток становится целью процесса.
Такая постановка задачи требует таких методов решения, которые способны гарантировать заданную степень асептики и воспроизводить результаты в промышленных условиях при длительной эксплуатации установок.
Основным методом стерилизации жидкостей и аппаратуры в лабораторных условиях является термический, связанный с достаточно длительным прогревом до заданной температуры.
Гибель микроорганизмов при повышенной температуре происходит, как правило, со скоростью, пропорциональной концентрации клеток или спор, еще сохранивших жизнеспособность к данному моменту времени:
![]()
Если в начальный момент времени при τ = 0 концентрация жизнеспособных особей составляла [хо], то ко времени τ она достигает величины:
![]() (*),
откуда
(*),
откуда ![]() , (1.1)
, (1.1)
где k – удельная скорость гибели,
ln![]() критерий
стерилизации.
критерий
стерилизации.
Практически важной характеристикой оказывается время, за которое концентрация выживших клеток снижается в 10 раз.
Из уравнения (*): τ10=2,303/к.
При стерилизации жидких сред обычно задается величина критерия стерилизации.
Затем по известному значению уд. скорости гибели при определенной температуре по уравнению (*) вычисляют необходимую продолжительность обработки τ.
Гибель клеток и спор резко ускоряется с ростом температуры.
В интервале 100-140 о С удельная скорость гибели клеток k возрастает в 104-105 раз, при повышении температуры на 10о С удельная скорость гибели клеток и спор возрастает в 10 раз и более.
Зависимость удельной скорости гибели клеток от температуры описывается уравнением Аррениуса:
k = А·exp-E/RT (1.2)
Постоянную E в этом уравнении по аналогии с химической кинетикой называют энергией активации процесса гибели микроорганизмов.
Объекты исследования, оборудование, реактивы и посуда:
- суспензия дрожжей (Saccharomyces cerevisiae) в объеме 500 мл на каждое занятие;
- микроскопы – 5 шт.;
- камера Горяева-Тома – 5 шт.;
- водяная баня (термостат) – 1-2 шт.;
- краситель (метиленовый синий);
- пробирки (5 шт. на бригаду);
- мерные цилиндры объемом 10 мл (5 шт.);
- пипетки объемом 1 или 2 мл (5 шт.);
- фильтровальная бумага;
- марлевые салфетки
