
- •Курсовий проект
- •1 Обгрунтування конструкції апарату
- •2 Характеристики хімічного продукту та термоносія
- •3 Вибір конструкційного матеріалу та матеріалу прокладки Для виготовлення обичайки колони обираю сталь
- •12Х18н10т-нержавіюча(легована конструкційна) яка містить 1,2% вуглецю,18 % хрому,10% нікелю,1% титану,а все інше залізо.
1 Обгрунтування конструкції апарату
Колонний апарат–призначений для розділення рідких сумішей,складові яких мають різну температуру кипіння. Класична колона являє собою вертикальний циліндр з контактними пристроями в середині.
Ректифікаційна колона може досягати 60 м у висоту та 6 м у діаметрі. У ректифікаційних колонах в якості контактних пристроїв застосовуються тарілки,які дали назву хімічному терміналу,і насадки. Насадка,що заповнює колону,може бути металева,керамічна,скляна…
Конденсація здійснюється на поверхні цих елементів.
Процес ректифікації здійснюють у ректифікаційній установці,що включає ректифікаційну колону,де флегма тор,холодильник – конденсатор,підігрівник вихідної суміші,збірники дистиляту й кубового залишку. Основним апаратом установки є ректифікаційна колона,у якій пари рідини,що перегоняються і піднімаються знизу,а на зустріч парами зверху стікає рідина,що подається в верхню частину апарату у вигляді флегми. У більшості випадків кінцевими продуктами, є дистилят (сконденсовані в дефлегматорі пари легколеткого компоненту,що виходить з верхньої частини колони ) і кубовий залишок(менш леткий компонент у рідкому виді,що витікає з нижньої частини колони).
Процес ректифікації протікає при атмосферному тиску,а також тисках вище і нижче атмосферного. Під вакуумом ректифікацію проводять,коли поділу підлягають висококиплячі рідкі суміші. Підвищений тиск застосовують для поділу сумішей,що перебувають у газоподібному стані при більш низькому тиску.
В моєму колонному апараті застосовуються тарілки типу ТСК-1-20 шт.
Тарілки типів ТСК-1:
К основі тарілки приварено зливний патрубок,з внутрішньої сторони тарілки к борту приварено опірне кільце для укладки ущільнювача .
2 Характеристики хімічного продукту та термоносія
Ацетон — летка безбарвна рідина з характерним запахом (Tпл 94,6 °С, Tкип 59,1 °С; Tзайм 20 °С; d420 )
0,7920; nD20 1,3588; γ 0,0273 н/м (20 °С)), змішується з водою та органічними розчинниками; межа вибухонебезпечності суміші з повітрям — 2,5–12,8%.
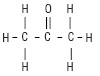
СН3СОСН3мол. м. 58,079.
За хімічними властивостями — типовий представник аліфатичних кетонів. Вступає в реакції нуклеофільного приєднання (з ціановодневою кислотою, гідросульфітами лужних металів, магнійорганічними сполуками), в реакції приєднання-відщеплення (з гідроксиламіном з утворенням кетоксиму, з гідразином і його похідними). Сильні окисники окиснюють до оцтової та мурашиної кислот і далі до вуглекислого газу і води.
У промисловості отримують прямим окисненням пропілену в рідкій фазі за наявності PdCl2:
![]()
та «кумольним способом» — одночасно з фенолом із бензолу і пропілену через ізопропілбензол (кумол):
При вдиханні він накопичується в організмі. Внаслідок повільного виведення можливе хронічне отруєння. ГДК — 200 мг/м3.
Бензо́л — перший представник гомологічного ряду ароматичних вуглеводнів. Безбарвна летка рідина з характерним запахом.З водою (91.17 мас%) утворює азеотропну сумішз температурою кипіння 69.25 °C. Перше промислове виробництво бензолу було з фракцій кам'яновугільної смоли, але з середини 20-го сторіччя практично весь промисловий обсяг бензолу виробляється дегідрогенізацією нафтової сировини. Бензол має цінні властивості як розчинник, але через його високу токсичність таке використання бензолу наразі дуже обмежено. Головна кількість бензолу є сировиною для промислового органічного синтезу, більш 2/3 бензолу іде на виробництво циклогексану.

Фізичні властивості:
Бензол — безбарвна рідина з своєрідним запахом. У воді не розчиняється. Густина — 0,88 г/см3. При 80,1 °C кипить, а при 5,5 °C замерзає в білу кристалічну масу. Бензол — добрий розчинник багатьох органічних речовин. У більшості органічних розчинників змішується в будь-яких відношеннях.
Одержання:
Бензол добувають головним чином з кам'яновугільної смоли, яка утворюється при коксуванні вугілля, бом ректифікаційної її розгонки та з нафти.
Або синтетичним способом з інших вуглеводнів, зокрема за реакцією М. Д. Зелінського при полімеризації ацетилену в присутності активованого вугілля як каталізатора при нагріванні.
Застосування:
Бензол є дуже важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензолу, який за реакцією М. М. Зінін а відновлюють в анілін:
У техніці цю реакцію проводять при дії на бензол хлоридної кислоти в присутності залізних стружок. Залізо, реагуючи з кислотою, утворює водень, який у момент виділення відновлює нітробензол. З аніліну синтезують найрізноманітніші органічні барвники і фармацевтичні препарати. Значні кількості бензолу використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлорциклогексан, який одержують з бензолу (реакція наведена вище), під назвою гексахлоран застосовується в сільському господарстві як один з найбільш ефективних засобів для знищення комах. Крім того, бензол використовують для синтезу багатьох інших органічних сполук і як розчинник
