
- •28. Сравнение хим. Обезжиривания и э.Х. Обезжиривания. М-зм этих процессов. Усл. Реализ. Для цв. И черн. Мет. Пути интенсифик. Проц. Обезжир, сниж. Энергозатр. Методы контроля состояния поверхности.
- •Электрохимическое производство гипохлорита натрия
- •Электрохимическое получение хлоратов
- •Определяющий фактор в выборе технической схемы производства NaClO3 является соотношение на пар и на электричество.
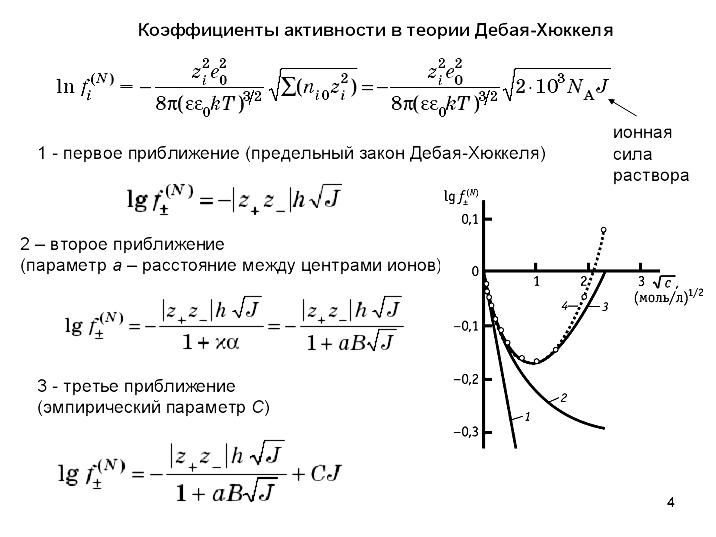
3. Теория межионного взаимодействия. Модель раствора электролита по Дебаю и Гюккелю.
Основные положения
1. Предполагается, что электролит полностью диссоциирован, т.е. теория приложима к растворам сильных электролитов.
2. Между ионами в растворе действуют только электростатические (кулоновские) силы притяжения и отталкивания.
3. Растворитель представляется в виде непрерывной среды с диэлектрической проницаемостью e, поэтому взаимодействие ионов с молекулами растворителя (сольватация) не учитывается.
4. В очень разбавленных растворах ионы можно рассматривать как геометрические точки, несущие на себе заряд.
 1/c ‑ характеристическая
длина,
представляет собой радиус ионной
атмосферы, окружающей центральный ион.
1/c ‑ характеристическая
длина,
представляет собой радиус ионной
атмосферы, окружающей центральный ион.
Что не учитывает теория ДГ
Рассматривается только электростатическое межионное взаимодействие, которое вместе с тепловым движением приводит к образованию сферической ионной атмосферы. Справедливо только для разбавленных растворов.
Увеличение концентрации приводит к уменьшению межионного расстояния, начинают проявляться силы межмолекулярного взаимодействия, например, силы Ван-дер-Ваальса, а размер ионной атмосферы становится соизмеримым с размерами самого иона. В этом случае уже нельзя рассматривать ионы как точечные заряды.
При расчетах используется разложение показательной функции в ряд с ограничением двумя или одним членом разложения, что соответствует ограничению разбавленными растворами.
Допущение о равенстве диэлектрической проницаемости раствора диэлектрической проницаемости растворителя также справедливо только для разбавленных растворов.
Не учитывается взаимодействие ионов с растворителем.
28. Сравнение хим. Обезжиривания и э.Х. Обезжиривания. М-зм этих процессов. Усл. Реализ. Для цв. И черн. Мет. Пути интенсифик. Проц. Обезжир, сниж. Энергозатр. Методы контроля состояния поверхности.
Обезжиривание в органических растворителях применяется для очистки от минеральных масел, неомыляемых жиров, полировальных паст, остатков консервационной смазки.
Недостатки хлорированных углеводородов - их сравнительно высокая стоимость и высокая токсичность. Однако применение механизированных и закрытых моечных установок, снабженных вытяжкой вентиляцией и устройством для регенерации загрязненного растворителя, обеспечивает быстроту, высокое качество и безопасность мойки. Фторированные углеводороды нетоксичны, но дефицитны.
хим обезж-ие водн. р-рами для стали, сплавов цв. Ме (Cu, Zn, Sn, Al)
Химическое обезжиривание осуществляется обработкой деталей в щелочных растворах. Р-ры содержат в своем составе едкий натр, соду кальцинированную, фосфаты и ПАВы. Щелочные компоненты оказывают омыляющее действие на жировые загрязнения, переводя растительные и животные жиры в растворимую форму в рабочем р-ре,обеспеч. высокую ЭП,облад.сильными высаливающим действием на галлогенные ПАВ. Фосфаты (ортофосфаты и полифосфаты) улучшают моющую сп-сть, снижают жесткость воды. Существенный эффект при хим-ом обезжиривании создается введением ПАВ, которые, эмульгируя жировые загрязнения, отрывают их от поверхности металла. Для обезжиривания Ме, растворяющихся в щелочах алюминия, цинка, олова, применяют растворы на Основе слабо-гидролизующихся щелочных солей - кальцинированной соды, карбоната калия (поташа), тринатрийфосфата. При хим. обезжиривании следует применять разбавл.-р-ры щелочей так как концентрированные щелочные р-ры обладают способностью образовывать оксидные пленки на поверхности деталей, изготовленных из стали, меди и медных сплавов. Повышенное содержание щелочи может вызвать пассивацию и коррозию изделий. Коррозия легких Ме происходит при рН 10, коррозия цветных металлов - при рН > 12,5. Фосфаты натрия Nа2РО4 и Nа4Р2О7, образуют щелочную среду в результате гидролиза; обладают буферными свойствами, поддерживая концентрацию водородных ионов при изменении состава раствора. Они также обладают поверхностно-активными свойствами: пептизируют загрязнения. Фосфаты уменьшают жесткость воды, образуя комплексные соединения с солями кальция и магния. Химическое обезжиривание производят при температуре 70— 90 °С, при которой омыление и процесс эмульгирования протекают более интенсивно. Продолжительность обезжиривания зависит от степени загрязнения деталей и составляет примерно 3—20 мин. Увеличение температуры и перемешивание раствора ускоряют удаление масла с поверхности. Из фосфатов наилучшими обезжиривающими свойствами обладают ортофосфаты и полифосфаты; концентрацию последних берут в 2—3 раза меньше. Силикат натрия кроме мягкого щелочного действия оказывает ингибирующее и эмульгирующее действие. Силикаты при гидролизе образуют нерастворимую кремниевую кислоту, находящуюся в коллоидном состоянии, способность которой диспергировать твердое вещество улучшает качество очистки поверхностей и предотвращает повторное осаждение загрязнений на поверхность деталей. После обработки в р-рах, содержащих силикат натрия, на поверхности металлов остается тонкая пленка. Фосфаты и силикаты хорошо смываются водой. Кроме того, в присутствии фосфатов лучше смываются едкий натр и карбонат натрия. После обезжиривания в растворах силикатов необходима тщательная промывка деталей в нейтральной или слегка щелочной воде. Оптимальная концентрация щелочи зависит не только от материала детали, но и от наличия в растворе того или иного ПАВ. Для стальных деталей максим. Кон-ция щелочи 100 г/л, для медных — 50 г/л, а для амфотерных металлов, способных растворяться в щелочных растворах, обезжиривание проводят в растворах, которые содержат соли щелочных металлов, — Nа2СО3, Na2Si3, Nа3РО4 и т.
Э/х обезжиривание поверхности деталей применяют для удаления незначительных жировых загрязнений оставшихся после хим. обезжиривания. Э/х обезжиривание деталей осуществляют на катоде, на аноде, или комбинированным методом – последовательным переключением полярности (катод-анод), причем анодную обработку ведут кратковременно. Э/х обезжиривание – более эффективный процесс по сравнению с хим. обезжириванием.
В процессе э/х обезжирив. жиры эмульгируются выделяющимися пузырьками водорода (при катодном обезжиривании) или кислорода (при анодном обезжиривании).В первом случае вследствие интенсивного разряда ионов водорода на катоде в прикатодном слое электролита, граничащем с поверхностью обрабатываемых деталей, происходит обогащение гидроксильными ионами, которые омыляют жиры живот. и раст. происхождения.
Обильное газовыделение способствует разрыву жировой пленки и каплеобразованию под действием сил поверхностного натяжения. При поляризации поверхности металла краевые углы образовавшихся жировых капелек уменьшаются и силы сцепления их с металлом снижаются. Газовые пузырьки, выделяющиеся на поверхности обрабатываемых деталей, отрываясь от нее, задерживаются на границе между жировой пленкой и электролитом. Этот процесс идет интенсивно и непрерывно. По мере увеличения размеров газовых пузырьков масляные капельки вытягиваются. Силы сцепления масляных капелек с поверхностью металла уменьшаются. Масляные капельки отрываются и увлекаемые газовыми пузырьками всплывают на поверхность электролита.
Выделяющийся на катоде водород частично диффундирует вглубь металла, нарушая первоначальное состояние кристалл. решетки, вызывая изменение физ. свойств металла. При этом появляется так называемая водородная хрупкость металла.
Э/х обезжиривание деталей из меди, цинка, алюминия и их сплавов осуществляется только на катоде.
Повышение плотности тока интенсифицирует процесс э/х обезжирив. и способствует снижению наводораживания. Уменьшить наводораживание и ускорить процесс э/х обезжиривания можно, применяя реверсирование постоянного тока.
Для э/х обезжиривания применяют в основном те же в-ва, что и при хим. обезжиривании. NaOH омыляет жиры, обеспечивает высокую электропроводность раствора. Na2CO3 обладает сильным высаливающим действием на ионогенные ПАВ и загрязнения – 20-40 г/л. Фосфаты (Na3PO4) обладают высокими диспергирующими свойствами, хорошей смываемостью. Кроме того, фосфаты снижают концентрацию солей жесткости – 30-50 г/л. Силикат натрия (жидкое стекло) – мягкий щелочной компонент, который обладает ингибирующими и эмульгирующими свойствами, выступает как ингибитор коррозии – до 4 г/л. ПАВ обычно не вводят, а если добавляют, то в небольших количествах. В ряде случаев используют растворы с более низким содержанием компонентов.
Пути интенсифик. проц. обезжир, сниж. энергозатр.
1использ. компл ПАВ–обеспеч сниж темпер при дрстиж выс степ обезжир
2интенс гидродин реж
3использ струйного обезжир
4обезжир в паровой фазе-осущ при повыш темпер, при сравнит низк содерж ПАВ. Такое обезжир провод для изделий не подверг кор проц.
5для интенс проц исп УЗ обезжир. Оно позвол на 2-3 пор интенсиф проц и ув частоту.
ЭХО для спл Al не применяется.
ЭХО изделий из цв мет произв только катодно. В ряде случ обезжир биологич мягкими препаратами: ТМС-31 50-70, МЛ-51 30-50 t 70
После любого обезжиривания обязат теплая промывка.
Методы контроля состояния поверхности.
Гл критерий обезжир – смачивание поверхности водными растворами
1 МЕТОД МАЗКОВ – фильтр бум взвеш, вытер опред площ и опять взвеш
2 ОПТИЧ МЕТОДЫ (микроскопический метод)
3 УФ излуч.
31. Общая х-ка электродных процессов при осаждении металлов из простых и компл. эл-тов. Виды перенапряж. Х-ка скоростьопределяющих стадий. М-зм восстан. на катоде комплексных анионов и катионов металлов.
Водные эл-ты дел-ся на простые и компл. В их состав входят: вода; сам Ме в виде сульфатов, хлоридов, реже нитратов, фосфатов и др.; буферная добавка; эл. провод. добавки; активаторы; комплексообраз. и ПАВы.
В простом эл-те ионы Ме нах-ся в гидратированом сост., к-ое хар-ся теплотой сольватации. В основе строен компл. лежит теор Вернера. Компл. соед. основано по донорно-акцепторному мех-му. Сост. комплексов опр-ся конст нестойкости. Кат. проц. можно разбить на стад.: доставка разряж-ся ч-ц к эл-ду (диффузия, конвекция, эл.миграция); формир-е ДЭС; адсорбция; разряд; формир-е кат. осадка или выдел. газообр. продуктов.
Каждая из этих стадий вносит свой вклад в энергетику электродного процесса:
η= ηдиф+ ηхим+ ηэх+ ηфаз
Меz+хH2O↔Ме0+ хH2O
В простых эл-ах наряду с этим процессом происходит выделение Н2
2Н3О+ + 2е= H2+2H2O
или 2H2O + 2е= H2+2ОН-
На катоде может происходить восстановление поливалентных Ме
Меz1+ + хе= Меz2+ (z2<z1)
Cr6+ разряжается до Cr3+ и Cr0, а также на катоде может происходить деструкция органических добавок, она связана с гидрированием. Побочные процессы в комплексных эл-тах еще в большей степени выражены при разряде комплексных частиц, т. к. он происходит при более электроотрицательном потенциале.
Zn2+ + 2e=Zn0 E0= - 0,76 B
[Zn(CN)]2- + 2e=Zn0 +4CN E0= - 1,22 B
Есть несколько точек зрения на счет стадий разряда при катодном осаждении.
Доставка ч-ц, адсорбция, ДЭС затем разряд с распадом сольватированных ч-ц и обр-ем на пов-ти ад-атома и затем электрокрист. Но эта точка зрения неоправданна тем, что энергия связи гидратир., так и компл. ч-ц дост. велика и они не могут расп-ся одномоментно. Точка зрения Бокриса и Конвейна гов. о том, что сольватированные, а тем более комплексные ч-цы, после доставки адсорбируются. Пов-ть эл-да энергетически неоднородна, она имеет различные активные центры. По их мнению разряд ч-ц происх. по след. схеме: доставка ч-ц затем адсорбция и формирование ДЭС затем миграция ад-ионов с распадом и в конце разряд и электрокрист. Эта схема обоснована энергетич. взаимодействиями и явл. наиболее оправданной. В комплексных эл-тах распад идет ступенчато.
Zn(CN)42=Zn(CN)3 + CN
Zn(CN)3= Zn(CN)2 + CN
Zn(CN)2= Zn(CN)+ + CN
Zn(CN)+= Zn2+ + CN
При диссоциации компл. ч-ц ч-цы с меньшим числом лигандов всегда мене р-римы, чем нач. ч-цы (с большим числом лигандов) и в прикат. слое могут образов. коллоидные ч-цы. Также в прикат. простр-ве растет вел-на рН, т.к. происх. выдел. Н2. Коллоидные частицы перенапряжение разряда и это способствует образованию мелкокристаллическихосадков.


50. Хим- и электрополирование. ЭХРО. М-зм проц. Состав и свойства раб р-ров. Усл реализации.
Электрохимическое полирование проводят на аноде преимущественно в кислородсодержащих кислотах (Н3РО4, H2S04, H2Cr207, НСlO4 и др.) достаточно большой концентрации при относительно высоких плотностях тока. В некоторых случаях применяют смеси минеральных и органических кислот, растворы щелочей (для цинка), цианидов (для серебра), HBF4 (для алюминия), добавляют к электролитам спирты, эфиры, аминосоединения, ингибиторы травления и др.
Выравнивание и сглаживание микрорельефа поверхности при электрохимическом полировании происходит за счет неодинаковой скорости растворения выступов и углублений.
Сглаживание поверхности при электролитическом полировании связано с образованием на ней вязкого слоя из продуктов анодного растворения металла. Этот слой («вязкая пленка») имеет большое электрическое сопротивление и неодинаковую толщину на различных участках шероховатой поверхности полируемого металла: большую в углублениях, меньшую на выступах.
Так как при этом сопротивл. прохождению тока на выст. оказыв. меньше, чем в углублениях, то первые р-ряются интенсивнее, что приводит к выравниванию микрошероховатости пов-ти. Большую роль играет также скор. диффузии продуктов ан. р-рения от пов-ти эл-да в глубь эл-та, к-ая также неодинакова у выступов и углублений. Вследствие того, что градиент конц. продуктов ан. р-рения на выст. больше, чем в углублениях, в первую очередь будут р-ряться выступы.
Значит. роль в мех-ме электрополирования отводится эл. хим. неоднородности пов-ти, связанной с особ. стр-ры металла. При эл. хим. полировании происх. р-рение в первую очередь наиболее выгодных в энергетич. отнош. участков пов-ти, какими явл. несовершенные эл-ты крист. решетки пов-го слоя (выступ. грани, недостроенные места кристалла ит.д.).
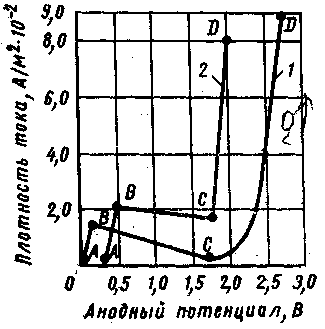 Изменения
состояния поверхности в ходе процесса
иллюстрируются характерными участками
кривых анодной поляризации. Анодные
поляризационные кривые при электрохимическом
полировании никеля (1) в растворе
H2S04
(плотность 1,6 г/см3)
при 40 °С и меди (2) в растворе Н3Р04
(плотность
1,55 г/см3)
при'20°С.
Изменения
состояния поверхности в ходе процесса
иллюстрируются характерными участками
кривых анодной поляризации. Анодные
поляризационные кривые при электрохимическом
полировании никеля (1) в растворе
H2S04
(плотность 1,6 г/см3)
при 40 °С и меди (2) в растворе Н3Р04
(плотность
1,55 г/см3)
при'20°С.
Первый участок кривых АВ соответствует активному состоянию поверхности металла. В этой области потенциалов происходит травление металла. Второй участок кривых ВС соответствует резкому самопроизвольному скачку потенциала анода в положительную область уменьшении плотности поляризующего тока.
На третьем участке кривых CD, в этой области потенциалов полирование сопровождается выделением газообразного кислорода вследствие разряда гидроксильных ионов, и качество обработки поверхности значительно ухудшается — появляются точечные язвы (питтинг).
При объяснении причин сглаживания шероховатой поверхности в области значительного повышения потенциалов (ВС) выступы и углубления пассивируются не в одинаковой степени и что окисная пассивная плёнка обладает ионной проводимостью, поэтому, наряду с электрохимическим окислением, может частично идти процесс ионизации металла. Пассивная пленка в углублениях более устойчива и имеет большую толщину, чем на выступах, вследствие чего последние быстрее растворяются.
Вязкая пленка продуктов анодного растворения, которой приписывается главная роль в механизме полирования металлов, в данном случае рассматривается как возможный регулятор скорости растворения пассивирующего окисного слоя.
Электрохимическое полирование применяют, главным образом, для отделки не сложных по форме изделий из стали, серебра, алюминия, меди и их сплавов, а также изделий после покрытия их другими металлами (никелем, медью).
В качестве электролита с органическими добавками для электрохимического полирования углеродистых и низколегированных сталей рекомендуется раствор состава: H2S04 40—60%, Н3Р04 40—60%, эфир дикарбоно-вой кислоты (например, диамиловый эфир себациновой кислоты) 1—2 г/л, сульфопонат (ПАВ) 0,5—1 г/л и для нержавеющих сталей—H2S04 10—30%, Н3РО4 50—70%, Н20 10—30%, сульфопо-'нат 1—5 г/л, пеногаситель (ПМС-200) 0,01—0,5 г/л.




 если
если




 электролита.
электролита.

74. Электросинтез кислородных соединений хлора-гипохлоритов, хлоратов. Общие сведения. Условия электролиза, электродные материалы. Основные технологические параметры.
