
- •1.Уравнение Гиббса.Каким образом величина изменения энергии Гиббса характеризует возможность протекания данного процесса?
- •2.Что представляют собой стандартные значения термодинамических функций?Для каких условий они рассчитываются?
- •3.Какая величина называется «химическим потенциалом»?От каких факторов зависит его значение?
- •4.Что такое «стандартный химический потенциал»?От чего зависит его значение?
- •5. Общее свойство всех термодинамический функций.Закон Гесса
- •6. Зависимость изменения энтальпии от температуры.Уравнение Кирхгофа
- •10.Какая величина называется скоростью гомогенной химической реакции. Привидите математическое выражение!
- •11. Факторы, влияющие на скорость химической реакции:
- •12. Какое соотношение описывает зависимость скорости химической реакции от концентрации реагирующих веществ? Закон действующих масс
- •Закон действующих масс в химической кинетике
- •Закон действующих масс в химической термодинамике
- •13. Какие соотношения описывают зависимость скорости химической реакции от температуры?
- •14.Какие вещества называются катализаторами?Что такое ингибиторы?
- •16. Каков физический смысл константы скорости реакции? От каких факторов зависит значение этой величины?
- •17. Вывод кинетического уравнения реакции I-го порядка.
- •18. Вывод кинетического уравнения реакции II -го порядка.
- •19.В чём заключается сущность графического метода определения порядка реакции?
- •20.Какая величина называется энергией активации?Каков её физический смысл?
- •21.Каков механизм действия катализаторов?Энергетические схемы обычных и каталитических реакций.
- •25.Какое явление называется диффузией? Что такое скорость диффузии? Уравнение Фика.
- •26.Какие системы называются растворами? Классификация растворов по агрегатному состоянию.
- •27.Какой способ выражения концентрации называется массовой долей?
- •28.Какой способ выражения концентрации называется молярной концентрацией?
- •29.Какой способ выражения концентрации называется моляльной концентрацией?
- •30.Какой способ выраженияконцентрации называется моляльной долей?
- •31.Каким образом растворимость газов зависит от давления газа?Закон Генри
- •32. Каким образом растворимость газов зависит от температуры и от наличия в растворе других растворённых веществ?
- •33.Какой общий принцип определяет растворимость жидких и твёрдых веществ в жидкостях?
- •37. Какое уравнение описывает зависимость осмотического давления от концентрации растворённого вещества?
- •38.Какова роль осмоса в процессах жизнедеятельности растительных и животных организмов?
- •39. Каким образом температуры кипения растворов отличаются от температур кипения растворителя? Эбулиоскопическая постоянная
- •40.Каким образом температуры замерзания растворов отличаются от температур замерзания растворителя?Криоскопическая постоянная?
- •41.На какие группы делятся вещества по поведению в процессе растворения?в чём заключаются особенности поведения растворов электролитов и неэлектролитов?
- •42.Какая поправка вносится в законы,описывающие ависимость свойств растворов электролитов от их состава?
- •43. Произведение растворимости труднорастворимых электролитов.
- •44. Электролитическая диссоциация воды. Ионное произведение воды. РН раствора.
- •45. Какие свойства растворов называются коллигативными?
- •49.Какие величины используются для количественной оценки процесса набухания?
- •50.Для каких полимеров характерно явление неограниченного набухания? Кривые неограниченного набухания.
- •51.Для каких полимеров характерно явление ограниченного набухания? Ограниченное набухание линейных полимеров.Кривые ограниченного набухания.
39. Каким образом температуры кипения растворов отличаются от температур кипения растворителя? Эбулиоскопическая постоянная
Рауль экспериментально доказал, чтоповышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Эбулиоскопия (от лат. ebulio — вскипаю) — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:где x1 — мольная доля растворителя.Видно, что при повышении концентрации растворенного вещества давление пара над раствором будет снижаться, а следовательно, при неизменном внешнем давлении, будет расти температура кипения.
С учетом уравнения Клапейрона — Клаузиуса можно показать[1], что изменение температуры кипения раствора (ΔTboil) может быть рассчитано по формуле:
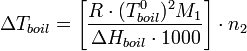
где ΔHboil — энтальпия испарения;
M1 — молярная масса растворителя;
n2 — моляльная концентрация растворенного вещества.
Дробь в квадратных скобках в этом выражении зависит только от свойств растворителя — это так называемая эбулиоскопическая константа растворителя ε. Она равна повышению температуры кипения одномоляльного раствора.
40.Каким образом температуры замерзания растворов отличаются от температур замерзания растворителя?Криоскопическая постоянная?
Температура замерзанияраствора ниже температуры замерзания чистого растворителя, так как парциальное давление пара растворителя над растворомвсегда меньше, чем давление пара над самим растворителем при той же температуре. Постоянной температурой замерзания обладают эвтектики. Связь температуры замерзания раствора с составом раствора определяется Рауля законами, графически может быть представлена диаграммой состояния, рассматривается, в частности, в двойных системах. Изучение понижения температурзамерзания растворов составляет предмет криоскопии. Криоскопическая постоянная отражает и учитывает причины отклонения от идеального поведения растворов, например сильную гидратацию веществ или структурированость растворителя.
41.На какие группы делятся вещества по поведению в процессе растворения?в чём заключаются особенности поведения растворов электролитов и неэлектролитов?
В процессе растворения по поведению вещества делятся на растворимые и нерастворимые. Все вещества принято условно делить по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давления пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов. В отличие от растворов электролитов, в растворах неэлектролитов (мол. р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. Растворы неэлектролитов служат средой, в к-рой протекают многие прир. и пром. Процессы .
