
- •1. Особенности строения и биологическая роль природных пептидов. Пептидная связь. Качественные реакции на пептиды. Методы анализ аминокислотных последовательностей
- •Биологически активные пептиды
- •2. Состав нуклеиновых кислот. Пуриновые и пиримидиновые основания. Нуклеозиды и нуклеотиды. Строение и номенклатура. Полинуклеотиды. Первичная и иные структуры рнк и днк.
- •2. Днк. Содержание в организмах, локализация в клетке. Первичная и вторичная структуры. Принцип комплементарности. Третичная структура днк (хроматин). Биологические функции днк.
- •1. Химические свойства аминокислот. Биологически важные химические реакции аминокислот. Пиридоксальфосфат. Альдимин I. Трансаминирование и декарбоксилирование аминокислот в организме.
- •2. Нуклеозидмонофосфаты и полифосфаты. Их функции и значение в метаболизме.
- •1. Форма белковых молекул. Глобулярные и фибриллярные белки. Олигомирные белки. Преимущества четвертичной структуры белков и ферментов.
- •2. Макроэргические соединения. Атф как универсальный источник энергии. Другие макроэргические соединения и их биологическая роль.
БИЛЕТ № 1
1. Аминокислоты. Классификация и свойства. Понятие об изоэлектрической точке. Протеиногенные и непротеиногенные аминокислоты. Их биологическая роль. Заменимые и незаменимые аминокислоты. Источники незаменимых аминокислот.

α-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у α-атома углерода.
Существуют разнообразные способы классификации аминокислот.
I. По способности синтезироваться в организме:
- заменимые - α-аминокислоты, которые синтезируются в организме;
- незаменимые - α-аминокислоты, которые не синтезируются в организме и должны поступать извне: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан.
II. Одним из классификационных признаков служит химическая природа радикала R:
- алифатические;
- ароматические (фенилаланин, тирозин);
- гетероциклические (триптофан, гистидин, пролин).
В химии α-аминокислот большое внимание уделяется строению и свойствам «боковых» радикалов.
III. В зависимости от характера бокового радикала выделяют две группы:
- α-аминокислоты с неполярными (гидрофобными) радикалами. К этой группе относятся α-аминокислоты с алифатическими боковыми радикалами – аланин, валин.
- α-аминокислоты с полярными (гидрофильными) радикалами. К этой группе принадлежат α-аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к ионизации (ионогенные) или неспособные переходить в ионное состояние (неионогенные) в условиях организма.
Полярные α-аминокислоты с ионогенными группами в радикалах в определенных условиях могут находится в ионном (анионном и катионном) состоянии.
В белках ионогенные группы радикалов, как правило, располагаются на поверхности макромолекул и обуславливают ионные (электростатические) взаимодействия. В роли полярных неионогенных групп в радикалах часто выступают спиртовые гидроксильные группы, например, в серине и треонине, или амидные группы, например, в аспарагине и глутамине. Полярные неионогенные радикалы могут располагаться как на поверхности, так и внутри белковых макромолекул. Они участвуют в образовании водородных связей с другими полярными группами.
IV. По включению в состав белков:
- белковые (протеиногенные) – 20 аминокислот, встречающиеся в составе белков: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин
- небелковые.
Химические свойства аминокислот
Кристаллические аминокислоты хорошо растворяются в воде.
В водном растворе α-аминокислоты существуют в виде равновесной смеси цвиттериона, катионной и анионной форм. Значение рН, при котором концентрация цвиттериона максимальна, а минимальные концентрации анионных и катионных форм α-аминокислот равны, называется изоэлектрической точкой.
Наличие в составе молекул α-аминокислот двух различных функциональных групп кислотного и основного характера обуславливает амфотерные свойства. Поэтому α-аминокислоты образуют соли как со щелочами, так и с кислотами.
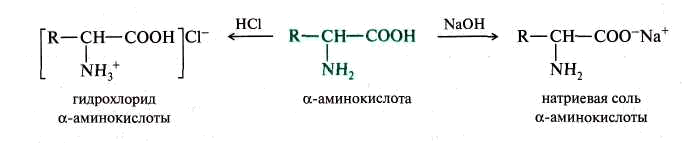
С катионами тяжелых металлов α-аминокислоты, как бифункциональные соединения, образуют внутрикомплексные соли.
α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные для карбоксильной и аминогруппы:
1. Образование эфиров – этерификация. В качестве катализатора выступает – газообразный хлороводород.
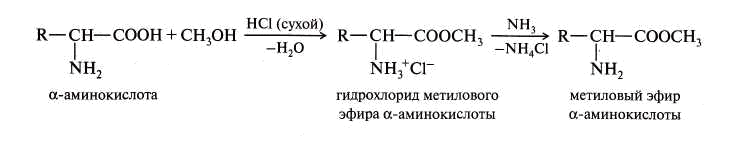
2. Образование галогенангидридов.
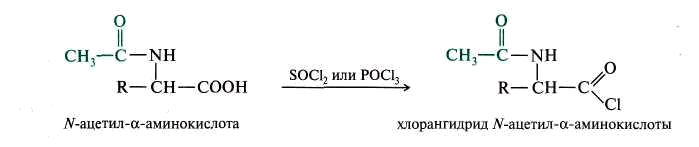
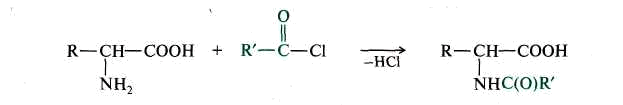
3. Образование N-ацильных производных.
4. Образование оснований Шиффа.
5. Образование ДНФ-производных.
6. Образование ФТГ-производных (реакция Эдмана).
2. Строение РНК. Сравнительная характеристика различных видов РНК. Информационные, транспортные и рибосомальные РНК. Строение и биологические функции. РНК как носитель генетической информации. Практическое использование мРНК в генной инженерии.
Первичная структура РНК представлена одинарной полинуклеотидной цепью
Наличие вторичной структуры у нее выражено слабее, но, тем не менее, оно возможно за счет складывания цепи с образованием шпильки, которая состоит из спаренных оснований, образующих двухцепочечный участок – стебель, часто с петлей из неспаренных оснований на одном конце.
Различают несколько видов РНК:
- матричные или информационные (иРНК), выполняющие роль матрицы в
белковом синтезе
- рибосомные (рРНК), выступающие в роли структурных компонентов
рибосом
- транспортные (тРНК), участвующие в процессе синтеза белка
- в культивируемых клетках человека обнаружен класс малых ядерных РНК
- в эукариотических клетках также присутствует большое число дискретных, высококонсервативных, небольших и стабильных молекул РНК
Строение тРНК.
Последовательность любой тРНК может быть изображена в форме клеверного листа, образуемого в результате спаривания оснований между комплементарными участками. В составе тРНК выделяют 4 основные ветви:
- акцепторная ветвь
- ветвь с дигидроуридиловой или D-петлей содержит 3 или 4 пары оснований;
- ветвь с псевдоуридиловой петлей содержит 5 пар оснований;
- антикодоновая ветвь, содержащая антикодоновый триплет в центре петли;
Третичная структура тРНК.
тРНК образуют компактные L(Г)-образные пространственные структуры, стабилизируемые водородными связями.
Строение рРНК.
Рибосомная РНК содержит в своем составе около 2% метилированных нуклеотидов, причем 80% метильных групп находится у С-2'-групп остатков рибозы. Последовательности рРНК так же как и последовательности тРНК обладают определенной степенью консервативности.
Вторичная структура также представлена наличием двухцепочечных участков, но их значительно больше.
В составе рибосом рРНК могут формировать третичную структуру, связываясь с белками этих субчастиц.
Строение иРНК.
иРНК не всегда достаточно стабильны.
Бактериальные иРНК значительно различаются по длине. Различают моно- и полицистронные иРНК, которые несут информацию о составе одного или большего числа белков. В составе всех иРНК можно выделить лидерный, кодирующий и концевой участки,
В молекулах иРНК содержится не только информация о последовательности аминокислот определенного белка, но также информация о том, когда, в каком количестве, в каком месте клетки и при каких условиях этот белок будет синтезирован.
ДНК хранит генетическую информацию, а РНК воспроизводит ее и переносит в среду, содержащую необходимые для синтеза белка исходные вещества.
Информация, заложенная в геноме (т.е. молекуле ДНК), не передается прямо к системе синтеза белка. Вначале она должна быть перенесена на РНК, и этот процесс называется транскрипцией (переписыванием).
Копируемая часть молекулы ДНК называется транскриптоном. Он содержит, как правило, информативную и неинформативную зоны, соотношение которых значительно варьирует. Транскрибирование информативной зоны приводит к образованию той части новообразуемой РНК, которая впоследствии дает начало белку с определенной функциональной активностью. Неинформативная часть РНК выполняет регуляторную функцию и в процессе созревания нуклеиновой кислоты разрушается.
БИЛЕТ № 2
1. Особенности строения и биологическая роль природных пептидов. Пептидная связь. Качественные реакции на пептиды. Методы анализ аминокислотных последовательностей
Пептиды представляют собой соединения, построенные из α-аминокислот.
Среди пептидов различают:
олигопептиды (низкомолекулярные пептиды) – содержат не более 10 аминокислотных остатков;
полипептиды – до 100 аминокислотных остатков.
Пептидную или белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающих с образованием пептидной (амидной) связи между мономерными звеньями. Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся амидных (CONH) и метиновых (CH)-групп. Атом углерода в пептидной группе находится в состоянии sp3-гибридизации.
Полипептидная цепь имеет удивительное однотипное строение и может быть представлена в виде ряда расположенных под углом друг к другу плоскостей пептидных групп, соединенных между собой через α-углеродные атомы связями Cα-N и Cα-Csp2. Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков.
Качественные реакции на пептиды. 1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. 2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет.
Биологически активные пептиды
Представителями самых маленьких пептидов являются содержащиеся в мышцах животных и человека карнозин (аланинлгистидин) и ансерин (аланил-N-метил-L-гистидин). Эти дипептиды могут выполнять буферные функции при физиологических значениях pH.
Один из наиболее распространенных трипептидов – глутатион (глутамилцистеинилглицин) – содержится во всех растениях, животных, бактериях.
Большое значение имеет группа пептидов, проявляющих гормональное действие, т.е. регулирующих химические реакции в организме.
Ответственный за контроль метаболизма углеводов, жиров и белков гормон инсулин вырабатывается поджелудочной железой.
2. Состав нуклеиновых кислот. Пуриновые и пиримидиновые основания. Нуклеозиды и нуклеотиды. Строение и номенклатура. Полинуклеотиды. Первичная и иные структуры рнк и днк.
Пуриновые и пиримидиновые основания.
В живых организмах они находятся не только в свободном виде, но и в виде нуклеозидов и нуклеотидов. Они не только образуют исключительно важные полинуклеотиды ДНК и РНК, но и играют значительную роль в обмене веществ, поскольку входят в состав АТФ, ЦТФ, ГТФ, УТФ, КоА, НАД(Ф), ФАД, АДФ-глюкозы и т.д.
Пуриновые основания.
Они представлены аденином и гуанином. Присоединение остатка сахара приводит к образованию нуклеозидов, а дальнейшее присоединение остатка фосфорной кислоты – к образованию нуклеотида
Пиримидиновые основания.
Основания этой природы, входящие в состав НК, представлены цитозином, тимином и урацилом. Нуклеозиды и нуклеотиды имеют строение, аналогичное нуклеотидам и нуклеозидам пуриновых оснований
Полинуклеотиды
К полинуклеотидам относят РНК и ДНК, играющим ключевые функции в процессе сохранения и передачи наследственной информации.
Структура ДНК
Только спустя многие десятилетия после её открытия Ф.Мишером в 1869 г. стало понятным, что ДНК является носителем генетической информации.
Первичная структура ДНК представляет собой последовательность азотистых оснований.
Вторичная структура представляет собой двойную спираль, образованную двумя полинуклеотидными цепочками, скрученными в правовращающую спираль вокруг одной и той же оси. Цепи могут быть разделены только путём раскручивания.
Структура РНК
Первичная структура РНК представлена одинарной полинуклеотидной цепью, поэтому она не подчиняется правилу равенства оснований Г = Ц и А = У, но при этом содержит много модифицированных оснований: дигидроуридин, псевдоуридин, метилцитидин и т.п. Роль углеводного остатка выполняет рибоза.
Наличие вторичной структуры у нее выражено слабее, но, тем не менее, оно возможно за счет складывания цепи с образованием шпильки, которая состоит из спаренных оснований, образующих двухцепочечный участок – стебель, часто с петлей из неспаренных оснований на одном конце.
Третичная структура тРНК. тРНК образуют компактные L(Г)-образные пространственные структуры, стабилизируемые водородными связями.
БИЛЕТ № 3
1. Химический состав, молекулярная масса и структура белков. Субъединичная структура. Методы выделения белков и ферментов. Роль различных связей в образовании первичной, вторичной, третичной структуры белков.
Белки представляют собой соединения, построенные из α-аминокислот.
Пептидную или белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающих с образованием пептидной (амидной) связи между мономерными звеньями. Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся амидных (CONH) и метиновых (CH)-групп. Атом углерода в пептидной группе находится в состоянии sp3-гибридизации.
Первичная структура пептидов и белков – это аминокислотная последовательность, т.е. порядок чередования α-аминокислотных остатков. Первичная структура определяется путем последовательного отщепления α-аминокислот с какого-либо конца цепи и их идентификации.
Вторичная структура белковой молекулы
Учитывая различные виды ограничений вращения вокруг σ-связей, Л. Полинг и Р. Кори расчетным путем показали, что для полипептидной цепи белка одной из наиболее выгодных конформацией является расположение в пространстве в виде правозакрученной спирали, названной ими α-спиралью.
Основную роль в закреплении такой конформации играют водородные связи, которые в α-спирали образуются между карбонильными атомами кислорода каждого первого и атомами водорода NH-группы пятого α-аминокислотных остатков.
Следует подчеркнуть, что понятие вторичной структуры относится не ко всей белковой молекуле в целом, а только к отдельным, обладающим некоторой протяженностью, участкам ее полипептидной цепи.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом или слоем. В складчатые слои укладываются вытянутые полипептидные цепи, связанные множеством водородных связей между пептидными группами этих цепей. Во многих белках одновременно содержаться α-спиральные и β-складчатые структуры.
Третичная структура белка
Дальнейшая укладка полипептидной цепи (фолдинг) приводит к формированию нативной пространственной структуры.
Считается, что третичная структура определяется, главным образом, особенностями первичной структуры
Большую роль в стабилизации третичной структуры играют водородные связи. Они могут возникать между функциональными группами боковых радикалов, а также между ними и пептидными группами. Кроме того, в формировании третичной структуры важную роль играют ионное (электростатическое) и гидрофобное взаимодействие, а также дисульфидные связи.
Ионное взаимодействие может возникнуть между ионогенными радикалами аминокислотных звеньев. К их числу принадлежат аминокислоты, имеющие дополнительные карбоксильные группы (аспарагиновая, глутаминовая кислота) и аминогруппы (лизин, аргинин).
Гидрофобное взаимодействие обусловлено ванн-дер-ваальсовыми силами притяжения между неполярными радикалами аминокислотных остатков.
Большое значение для поддержания третичной структуры имеет ковалентная дисульфидная связь, образующаяся между цестеиновыми остатками одной и той же или разных белковых цепей.
Дисульфидная связь содержится в очень многих пептидах и белках (окситоцин, вазопрессин, инсулин, лизоцим и др.).
Классификация белков
Ввиду многообразия пептидов и белков существует несколько подходов к их классификации.
По составу:
1. простые – при гидролизе таких белков образуются только α-аминокислоты;
2. сложные – наряду с собственно белковой частью содержат органическую или неорганическую части непептидной природы, называемые простетическими группами. Группа сложных белков делится на:
1) Хромопротеины, состоящие из простого белка плюс окрашенного небелкового компо-нента
2) Нуклеопротеины – белки, образующие с нуклеиновыми кислотами нуклеопротеидные частицы – рибонуклеопротеины и дезоксирибонуклеопротеины.
3) Липопротеины – белки, у которых небелковая часть представлена каким-либо липидом.
4) Фосфопротеины содержат остатки фосфорной кислоты.
5) Гликопротеины кроме белковой части содержат углеводы.
6) Металлопротеины содержат ионы одного и более металлов, которые связаны с белковой частью координационными связями.
II. По пространственной структуре:
1. глобулярные белки – характерна α-спиральная структура, а цепи их изогнуты в пространстве так, что макромолекула приобретает форму сферы.
2. Фибриллярные – более характерна β-структура.
