
- •1.Современное состояние гидролизного производства в Республике Беларусь.Перспективы его развития.
- •2.Сырье для гидролизной и микробиологической промышленности. Сырьевая база гидролизного производства Республики Беларусь.
- •3.Технологическая характеристика гидролизного сырья. Его подготовка, хранение и подача в про-во
- •4 Кинетика перколяционного гидролиза (пг) полисахаридов. Факторы влияющие на скорость гидролиза.
- •5 Константа скорости гидролиза пс. Факторы вл-е на скорость гидролиза пс.
- •6. Причины трудной гидролизуемости полисахаридов. Особенности гидролиза гц и ц.
- •7.Кинетика вторичных превращений моносахаридов. Факторы, влияющие на скорость распада моносахаридов.
- •8.Механизм кислотно-каталитического расщепления гликозидных связей пс разбавл. К-ми
- •9. Превращение ком-ов древесины в пр-се гид-за
- •10. Выход мс при одноступенчатом многоступенчатом и пггц. Влияние кинетических и макрокинетических факторов на реальный выход мс.
- •11. Классификация основных методов гидролиза.
- •I.По факторам химической кинетики.
- •II.Макрокинетические признаки(диффузионные и гидродинамич явления)
- •III.По техническим признакам.
- •12.Особенности гидролиза растительного сырья концентрированными кислотами. Превращение целлюлозы под действием концентрированных кислот.
- •13. Техн. Схема гид-го отделения.
- •16. Двухстадийный гидролиз растительного сырья с раздельным отбором пентозного и гексозного г-та.
- •17.Двухстадийный гидролиз растительного сырья с возвратом части гексозного гидролизата на загрузку и гидролиз гемицеллюлоз.
- •18.Устройство гидролизаппарата (г/а) периодическо действия(п/д).
- •20.Риу. Пути повышения эффективности его работы.
- •22.Химический состав гидролизата. Влияние компонентов гидролизата на процессы биохимической переработки.
- •24. Продуценты кб и требов., предъявл. К ним. Хар-ка микрофлоры ф-ов в пр-ве кд.
- •25. Влияние физических и химических факторов на мо. Способы хранения посевн-о мат-ла.
- •26. Строение и состав дрожжевой клетки.
- •27.Способы питания микроорганизмов. Особенности поступления питательных веществ в клетку.
- •29. Теоретические основы непрерывного глубинного культивирования дрожжей в режиме хемостата.
- •30.Фермен-ры и режимы ферм-ции в произ-ве корм дрож-й.
- •31.Двухступенчатая ферментация в произв-ве корм белка.
- •32.Технология концентрирования дрожжевой суспензии.
- •33.Сушка дрожж. Рецирк суш агента. Получ гран-го прод. Устр,прин действия срц и меропр,обесп её норм безопасн.
- •34. Технология производства кормовых дрожжей. Требов к кач-ву корм дрожжей. Технико-эк пок-ли произ-ва.
- •35.Проблема охраны окр среды в гидролизном произв-ве и пути их решения.
- •36.Состав и доброкачественность сфи щёлока, особ-сти его подготовки к ферментац процессам.
- •37. Предгидролизаты сф(а)вц. Состав и переработка.
- •38. Получение лс при перераб-ке сф(и)щ и их исп-ие.
- •39. Прямая микробиологическая трансформация целлюлозосодержащих материалов в этанол.
- •40. Ферментативный гидролиз растительного сырья, его преимущества и недостатки. Механизм ферментативного гидролиза.
- •41. Методы повышения реакц спос-сти ц из растит сырья
- •39. Прямая микробиол трансформации целлюлозосод-х субстратов с целью получэтил спирта
- •42.Перспективы и основные направления прямой биоконверсии растительного сырья.
- •44. Производство кормового гидролизного сахара.
- •45.Виды раст.-углевод. Добавок,принц.Их получ.
- •46.Получение рук-1 и рук-2
- •47.Облагораживание сырья,пг и очисткаПг в производстве пищевого ксилита.
- •49.Технология спирт брожения и пути её соверше-ния. Микрофлора. Способы борьбы с инфекцией.
- •50.Теоретич основы ректиф-го выд-ния и очистки этанола.
- •51. Технология пр-са ректификации спирта из бражки
- •52.Получение жидкого и тв со2
- •53. Методы получения фск
- •54. Технология получения фск с прим кислотных катализаторов.
- •55. Фурфурольно-гексозный гидролиз
- •56. Получение ф-ла в пр-се парофазного гид-за пентозансодержащ раст-го сырья с исп-ем солевых кат.
- •57. Кинетика образов-ия фур-ла.
- •59. Особен-ти технологии выделения ф-ла из конд-ов паров самоиспар-ия гидрол-та.
- •60.Производные ф. И принц. Их получ.
- •62.Технол.Получ. Фурфурил.Спирта фс
- •63. Пути создания малоотходных производств в гидролизном производстве. Окж исп и очистка.
- •64. Методы очистки сточных вод.
- •65 Харак-ка основных направлений использов-я гидролиз лигнина (л):
- •66.Методы химической переработки лигнина.
- •67.Использование гидролизного лигнина в натуральной форме.
- •70. Биосинтез белка в дрожжевой клетке.
- •72. Биохимия образования этанола дрожжами.
- •73. Производство премиксов.
- •74. Получ-ие мат-ов на основе сорбц-ых св-в л: полифепана,удоб-ий (лсу,ому), коллактивита.
- •31. Особ-ти получения эт. Спирта из пищевого сырья
- •32.Получение топливного этанола.
- •71 Ассимиляция мс и орг к-т…
6. Причины трудной гидролизуемости полисахаридов. Особенности гидролиза гц и ц.
В усл. гидролиза разбавл. к-ми при повышении тем-ры ГЦ переходят в р-р с обр-ем продуктов неполного гидролиза со СП от 2 до 10 в гомогенных усл. Высокая степень гидролиза объясняется свободным доступом kаt к каждой молекуле. Скор.г-за ГЦ в 300-400 раз больше чем Ц. Ц в этих усл-х ведёт себя иначе. При нагрев. она не переходит в р-р и процесс протек. в гетерогенных усл-х,в рез-те чего скор.гидролиза замедл. Решающую роль играет надмолек-я структура Ц. Прир-ая Ц в клетках растений обр-ет микрофибриллы неопр-ой длины, в кот макром-лы Ц связаны Н-связями различной прочности. Длина плотных участков > примерно в 10 раз, чем рыхлых. СП>2000. Чем плотнее упакована тем медленнее гидролизуется. Скор. Г-за рыхлых и плотных уч-в отлич.≈ в 100 раз. Вначале гидролиз.рыхлые уч-тки. Каждая молекула проходит 8-10 последовательных плотных и рыхлых участков микрофибрил. Отмечено изменение степени полимеризации Ц при гидролизе.(рис 1).
С
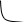
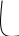 П древ.Ц
кипящей 5% Н2SO4
П древ.Ц
кипящей 5% Н2SO4
Хлопковая Ц
2 4 6 8 10 время,ч
Эта зав-сть объясняется наличием в Ц ТГ, плотноупокованных уч-в, кат проник. в рыхлые уч-тки микрофибрил, в тв-х участках действует на поверхности. Также имеет место рекристаллизации Ц. ≈1/3 Ц нах-тся в рыхлых уч-х .Т О гидролиз ГЦ начин.в гетерог-х усл-х, а заканчив. в гомогенных, а г-з Ц идет в гетерог-х усл-х.Особенности гидролиза ГЦ,2 стадии: 1) происх в гетерогенных усл-х мол-лы ПС рвутся на части и перех-т в р-р; 2) протекает одновременно с первой, это переход ПС в МС.
1 ст идет значит.быстрее, наз гидролитич раств-ем ПС ГЦ, а 2-их г-зом.обе стадии прот-ют один-во и чтобы их зафикс-ть необх пров-ть в очень мягких условиях
ПС ГЦ неоднородны и обладают различной реакционной способностью. По реакционной способности их можно разделить на две кинетические фракции, которые находятся в различных растительных тканях.Отличие закл-ся в след:
1) растворение ГЦ идёт значительно быстрее чем гидролиз, в рез-те накапливаются ОС и декстрины.
2)т к ГЦ неоднородны по своему составу, их г-з нельзя описать ур-ми I и II порядка.
3) Константа гидролиза изменяется с течением времени.
4) низкое кач-во сырья;
5) ↓ загрузки сырья в г/а.
Для ув-ния v г-за ГЦ разб к-ми необх обесп разрыхление ее стр-ры, пов-ние реакц спос-ти и последующее растворение в воде. Для этого разработан ряд методов предварит-ой обработки.
7.Кинетика вторичных превращений моносахаридов. Факторы, влияющие на скорость распада моносахаридов.
Мех-м кисл-го распада МС сложен и до конца не выяснен. Предполагают, что как и при гидролизе ПС ионы Н3О+ обр-т активные комплексы с ОН группами МС, что приводит к их дегидратации. Реакция распада в условиях гидролиза подчиняется ур-ю 1-го порядка т е:
dy/dt=k2(b-y), где b—исходное кол-во МС, y—кол-во сахара, разлагающегося за время t, k2—константа скорости распада сахара.
Интегрируем и получим k2=b(1-е-k2t), аналогично k2 можно представить в виде произведения частных констант: k2=α1Νδ1λ1 , α1 относит-ная каталит-кая активн. к-ты в реак. распада МС, Ν нормальность р-ра к-ты , δ1 относительная устойчивость МС , λ1 вл-е тем-ры на скор. распада МС.
1) δ1 :для сравнения способности МС-в распадаться принято соотносить скорости распада МС к скорости распада глюкозы. δ1= k2МС/k2ГЛ , δ ГЛ=1
2) α1 : каталитическая активность кислоты при распаде глюкозы
HCl H2SO4 HNO3 H3PO4 HCOOH CH3COOH
α1 1.0 0.5 0.23 0.11 0.07 0.06
При сравнении значений α установлено что они близки между собой, т.е. каталитич. активность проявл. Одинаково кА при г-зе ПС так и при распаде МС. Причем α1 H2SO4 зависит от ее конц.: с ↓ концентрации α1 ↑. Это объясняется тем, что при ↑ конц. H2SO4 ее способность к диссоциации ↓.
3) λ1– Измен-е Q10 от тем-ры имеет след.хар-р. Коэф-т Q10 для глюкозы ↓ с ↑ тем-ры от 130 до 230 °C.При распаде ксилозы он остается практич.неизменным. Уст-но, что v г-за Ц возр-ет более знач-но ↑, чем v распада D-GLu. С ↑ конц.МС в гид-те скорость их распада ув-ся. Это объясняется влиянием ОН ионов, которые вызывают распад глюкозы со скоростью значительно большей чем под влиянием Н+ ионов. Влияние ОН ионов можно пренебречь только при рН<3. Каталитич. действием H2O и ОН-ионов объясняется факт повышенного распада глюкозы в начальный период нагреванием в воде, затем распад тормозиться в связи с подкислением среды продуктами распада.
