
- •1.Современное состояние гидролизного производства в Республике Беларусь.Перспективы его развития.
- •2.Сырье для гидролизной и микробиологической промышленности. Сырьевая база гидролизного производства Республики Беларусь.
- •3.Технологическая характеристика гидролизного сырья. Его подготовка, хранение и подача в про-во
- •4 Кинетика перколяционного гидролиза (пг) полисахаридов. Факторы влияющие на скорость гидролиза.
- •5 Константа скорости гидролиза пс. Факторы вл-е на скорость гидролиза пс.
- •6. Причины трудной гидролизуемости полисахаридов. Особенности гидролиза гц и ц.
- •7.Кинетика вторичных превращений моносахаридов. Факторы, влияющие на скорость распада моносахаридов.
- •8.Механизм кислотно-каталитического расщепления гликозидных связей пс разбавл. К-ми
- •9. Превращение ком-ов древесины в пр-се гид-за
- •10. Выход мс при одноступенчатом многоступенчатом и пггц. Влияние кинетических и макрокинетических факторов на реальный выход мс.
- •11. Классификация основных методов гидролиза.
- •I.По факторам химической кинетики.
- •II.Макрокинетические признаки(диффузионные и гидродинамич явления)
- •III.По техническим признакам.
- •12.Особенности гидролиза растительного сырья концентрированными кислотами. Превращение целлюлозы под действием концентрированных кислот.
- •13. Техн. Схема гид-го отделения.
- •16. Двухстадийный гидролиз растительного сырья с раздельным отбором пентозного и гексозного г-та.
- •17.Двухстадийный гидролиз растительного сырья с возвратом части гексозного гидролизата на загрузку и гидролиз гемицеллюлоз.
- •18.Устройство гидролизаппарата (г/а) периодическо действия(п/д).
- •20.Риу. Пути повышения эффективности его работы.
- •22.Химический состав гидролизата. Влияние компонентов гидролизата на процессы биохимической переработки.
- •24. Продуценты кб и требов., предъявл. К ним. Хар-ка микрофлоры ф-ов в пр-ве кд.
- •25. Влияние физических и химических факторов на мо. Способы хранения посевн-о мат-ла.
- •26. Строение и состав дрожжевой клетки.
- •27.Способы питания микроорганизмов. Особенности поступления питательных веществ в клетку.
- •29. Теоретические основы непрерывного глубинного культивирования дрожжей в режиме хемостата.
- •30.Фермен-ры и режимы ферм-ции в произ-ве корм дрож-й.
- •31.Двухступенчатая ферментация в произв-ве корм белка.
- •32.Технология концентрирования дрожжевой суспензии.
- •33.Сушка дрожж. Рецирк суш агента. Получ гран-го прод. Устр,прин действия срц и меропр,обесп её норм безопасн.
- •34. Технология производства кормовых дрожжей. Требов к кач-ву корм дрожжей. Технико-эк пок-ли произ-ва.
- •35.Проблема охраны окр среды в гидролизном произв-ве и пути их решения.
- •36.Состав и доброкачественность сфи щёлока, особ-сти его подготовки к ферментац процессам.
- •37. Предгидролизаты сф(а)вц. Состав и переработка.
- •38. Получение лс при перераб-ке сф(и)щ и их исп-ие.
- •39. Прямая микробиологическая трансформация целлюлозосодержащих материалов в этанол.
- •40. Ферментативный гидролиз растительного сырья, его преимущества и недостатки. Механизм ферментативного гидролиза.
- •41. Методы повышения реакц спос-сти ц из растит сырья
- •39. Прямая микробиол трансформации целлюлозосод-х субстратов с целью получэтил спирта
- •42.Перспективы и основные направления прямой биоконверсии растительного сырья.
- •44. Производство кормового гидролизного сахара.
- •45.Виды раст.-углевод. Добавок,принц.Их получ.
- •46.Получение рук-1 и рук-2
- •47.Облагораживание сырья,пг и очисткаПг в производстве пищевого ксилита.
- •49.Технология спирт брожения и пути её соверше-ния. Микрофлора. Способы борьбы с инфекцией.
- •50.Теоретич основы ректиф-го выд-ния и очистки этанола.
- •51. Технология пр-са ректификации спирта из бражки
- •52.Получение жидкого и тв со2
- •53. Методы получения фск
- •54. Технология получения фск с прим кислотных катализаторов.
- •55. Фурфурольно-гексозный гидролиз
- •56. Получение ф-ла в пр-се парофазного гид-за пентозансодержащ раст-го сырья с исп-ем солевых кат.
- •57. Кинетика образов-ия фур-ла.
- •59. Особен-ти технологии выделения ф-ла из конд-ов паров самоиспар-ия гидрол-та.
- •60.Производные ф. И принц. Их получ.
- •62.Технол.Получ. Фурфурил.Спирта фс
- •63. Пути создания малоотходных производств в гидролизном производстве. Окж исп и очистка.
- •64. Методы очистки сточных вод.
- •65 Харак-ка основных направлений использов-я гидролиз лигнина (л):
- •66.Методы химической переработки лигнина.
- •67.Использование гидролизного лигнина в натуральной форме.
- •70. Биосинтез белка в дрожжевой клетке.
- •72. Биохимия образования этанола дрожжами.
- •73. Производство премиксов.
- •74. Получ-ие мат-ов на основе сорбц-ых св-в л: полифепана,удоб-ий (лсу,ому), коллактивита.
- •31. Особ-ти получения эт. Спирта из пищевого сырья
- •32.Получение топливного этанола.
- •71 Ассимиляция мс и орг к-т…
4 Кинетика перколяционного гидролиза (пг) полисахаридов. Факторы влияющие на скорость гидролиза.
По
кинет.признакам реак.гидролиза глик-х
связей ПС явл. медл.проц-м. На скор.гидролиза
вл-т разл-е фак-ры: реак-я способность,
тем-ра, кислотность. Гидролиз при повыш-х
тем-х приводит к втор-м превращ-м. С ↑
тем-ры и кислотности ↑ скорость гидролиза
гли-х связей, так и скорость деструкции
МС. Сущность реак.гидролиза: взаимод-е
ПС с водой, с разрывом ацет-х связей, с
присоед-м по месту разрыва Н+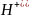 и
ОН-
и
ОН-
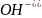 .
Реак.гидролиза:(С6Н10О5)n+(n-1)Н2О=n(С6Н12О6)
.
Реак.гидролиза:(С6Н10О5)n+(n-1)Н2О=n(С6Н12О6)
Катализаторы-минер.к-ты. Гидролиз осущ.в кислой среде где Н+ служит Kat реак. В ГП исп-тся разб-е к-ты(0,5-0,8%). В разб-х р-х дисоциирует в две ступени.
Эксперимен.найдены велечины кинет-х хар-к реак.явл. эф-ми или эмпир-ми, т.к. опред.по измен.относит.стабильных исх-х, промеж-х, конечных соед-й. из макрокинет-х ф-в на выход МС основное вл-е оказывают диффузионные и гидродинамические.В боль-ве проц-в лим стадией явл. превращение промеж-й формы в продукты реакц. Протонирование гликозидной связи с образ-м оксониевого макроиона и взаимод-е карбокатиона с ОН- протекает по бимолекулярному мех-му; расщепление оксониевого иона – по мономолекулярному мех-му. Лим стадия – деструкция оксониевого иона.
Скорость мономолекулярных реак. описывается ур-м 1 порядка. Исследования проводят по расходованию ПС или по образ-ю продуктов р-ии G (МС).
V
= kэф*P или V=kэф*G, к- эмпирический коэфф-т
скорости реак. Так же известны
псевдомолекулярные р-ии, но они так же
протек. по з-ну 1-го порядка, т.к. происходит при значительном
избытке воды для описания процесса
гидролиза применимо ур-е 1 порядка:
порядка, т.к. происходит при значительном
избытке воды для описания процесса
гидролиза применимо ур-е 1 порядка:
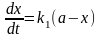 где а- кол-во исх-х ПС, х – кол-во ПС
прогидролизовавшихся за время t. После
преобразования получим :
где а- кол-во исх-х ПС, х – кол-во ПС
прогидролизовавшихся за время t. После
преобразования получим :
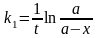
Для
данонго ПС величина k1 остается постоянной
для разл-х промежутков времени. Величина
k1 позволяет сравнивать скор. реак. в
разл-х усл-х и рассчитать эф-сть реак.
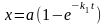 .
k1- критерий гидроллиза. По привед. ур-ю
можно рассчитать кол-во прогидролизованного
ПС и кол-во полученонго МС. Интегрир-м
ур-е 1-ого порядка:
.
k1- критерий гидроллиза. По привед. ур-ю
можно рассчитать кол-во прогидролизованного
ПС и кол-во полученонго МС. Интегрир-м
ур-е 1-ого порядка:
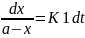 ;
;
 ;
При т=0,х=0, и
;
При т=0,х=0, и
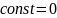 ;lna-ln(a-x)=K1t;
lna/(a-x)=K1t;
K1=1/t*lna/(a-x)
;lna-ln(a-x)=K1t;
lna/(a-x)=K1t;
K1=1/t*lna/(a-x)
Для
данного ПС величина К1=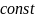 в разл-е промеж. врем. Велечины К1 гидролиза
позвол. сравнить скор.реак. в разл-х
усл-х и рас-ть эф-сть реак.
в разл-е промеж. врем. Велечины К1 гидролиза
позвол. сравнить скор.реак. в разл-х
усл-х и рас-ть эф-сть реак.
Ln(a-x)/a=-K1t;
ln(a-x)=ln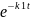 ;
(a-x)=aln
;
x=a-a
;
;
(a-x)=aln
;
x=a-a
;
X=a(1- )
Для практических целей нах-т применеие ур-е Шаркова. Оно позвол. дать оценку влияния разл-х ф-ров на k1 . k1= αNδλ
α- относит-ная каталит-кая активность, N - конц-я катализатора, δ – относит-ный коэф-т гидролиз-сти ПС, λ – темпер-ный коэф-т.
Каталит-кая активность к-ты опред. степенью её диссоциации в р-ре.
k1 нах-тся в прямой зав-сти от конц.к-ты. δ опр-т прочность гликозидных связей и определяется надмолекулярной структурой ПС. Спос-ть ПС гидр-ся опр-т принимая за 1 скорость гидролиза хлопковой Ц. Вл-е тем-ры оценивают с помощью влияния температурного коэффициента р-ии и её энергии активации .
5 Константа скорости гидролиза пс. Факторы вл-е на скорость гидролиза пс.
Шарковым В.И. было предложено эмпирическое ур-е, кот.устан-т связь м/д пар-ми проц.и его скор. Оно позвол.дать колич-ю оценку вл-я самых важных ф-в на К1. Велич. К1 зависит от многих ф-в: К1= α*N*δ*λ, где α- относит.каталит-я активность к-ты; N-конц-я к-ты; δ- относит-й коэф-т гидролизуемости ПС, хар-й устойчивость ПС к гидролизу; λ- темпер-й коэф-т.
α-
опред. степень
диссоциации к-ты в р-ре. НСL
в водн.р-ре практич.полн. дисоциирует(
α=1). НN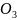 не исп-тся, т.к. при высоких температурах
она разлагается с образованием окислов.
Сущ-т ряд активности к-т Оствальда, хар-й
их активность к гидролизу:
не исп-тся, т.к. при высоких температурах
она разлагается с образованием окислов.
Сущ-т ряд активности к-т Оствальда, хар-й
их активность к гидролизу:
HI>HCIO4>HBr>HCI>HNO3>H2SO4>HCOOH
N- константа v гидролиза ПС нах-ся в прямой зав-сти от конц. к-ты. При гидролизе натуральной древесины в 2 раза вызыв. ↑ скорости гидролиза Ц не в 2 раза, а в 1,35. Это объясн.тем,что зола связыв. часть к-ты.Скор. гидролиза прямо проморциональна ↑ конц-ции к-ты в интервале 0,3-3%. δ-хар-т прочность гликозидных связей.
О пределяется надмолек.. Выход МС,%
с труктурой ПС. δ =1 для 1% к-та,мах в мс
хлопковой
Ц, для ели=1,5,
для ели=1,5,
сахароза
180000. Те ПС, кот. 0,5% к-та
Те ПС, кот. 0,5% к-та
г идролиз.со скор. близкой к
скор.гидролиза хлопковой Ц t
считаются тгпс.
λ- вл-е тем-ры оценив.с помощью темпер-го коэф-та. Q10- это величина измен.скор.реак.при измен.тем-ры на 10оС.
Q10=Кт+10/ Кт Согласно правилу Вант-Гофа ↑ тем-ры на 10 оС, ↑скор.реак. в 2 раза. С помощью эт.коэф-та можно рассчитать во сколько раз измен. скор.реак.при измен.тем-ры на ∆t.
n= Q100,1∆t ↑ тем-ры приводит к ↓ энер-го барьера. Зависимость скор.реак от тем-ры списыв.ур-м Арениуса:
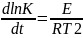
 энергия
активации,Дж/гмоль;
энергия
активации,Дж/гмоль;
 -газовая
постоянная,8,31 Дж/гмоль;
-газовая
постоянная,8,31 Дж/гмоль;
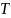 -
абс.тем-ра реак. Эн.активации м.определить
графически.lgK=f(
-
абс.тем-ра реак. Эн.активации м.определить
графически.lgK=f(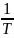 )
по тангенсу наклона прямой.
)
по тангенсу наклона прямой.
lgK
По след.ур-ю м. рас-ть энергию
Активации
 при
люб.температуре: α
при
люб.температуре: α
l n(KT2/KT1)=E/R*(1/T2-1/T1)
E=R* *lnQ10
*lnQ10
Также м.получить ф-лу позвол.опред-ть Qi при любом интервале тем-р:
Qi=
При неизменном ↓ Q10 происх значит ув-ние К1 при выс темп-рах(от 180 до 210).ум-ние энергет барьера.
