
- •Isbn 978-5-06-005815-4 © фгуп «Издательство «Высшая школа», 2007
- •Предисловие
- •Введение
- •Вода в природе и жизни человека
- •Водные объекты. Понятие о гидросфере
- •Гидрологический режим и гидрологические процессы
- •Науки о природных водах
- •Методы гидрологических исследований
- •Использование природных вод и практическое значение гидрологии
- •2. В числителе приведено полное, в знаменателе — безвозвратное водопотребление.
- •Глава 1 химические и физические свойства природных вод
- •Вода как вещество, ее молекулярная структура и изотопный состав
- •1.2. Химические свойства воды. Вода как растворитель
- •1.3. Физические свойства воды 1.3.1. Агрегатные состояния воды и фазовые переходы
- •Плотность воды
- •Тепловые свойства воды
- •Некоторые другие физические свойства воды
- •Глава 2 физические основы гидрологических процессов
- •Фундаментальные законы физики и их использование при изучении водных объектов
- •Водный баланс
- •Баланс содержащихся в воде веществ
- •Тепловой баланс
- •Основные закономерности движения природных вод
- •Классификация видов движения воды
- •Расход, энергия, работа и мощность водных потоков
- •Силы, действующие в водных объектах
- •Уравнение движения водного потока
- •Вертикальная устойчивость вод
- •Глава 3 круговорот воды в природе и водные ресурсы земли
- •Вода на земном шаре
- •Современные и ожидаемые изменения климата и гидросферы земли
- •Круговорот теплоты на земном шаре и роль в нем природных вод
- •Круговорот воды на земном шаре
- •И водные ресурсы Земли», 1974)
- •Вод в грунтах
- •Круговорот содержащихся в воде веществ
- •Влияние гидрологических процессов на природные условия
- •Водные ресурсы земного шара, частей света и россии
- •Та блица 3.6. Средние многолетние (1930—2000) водные ресурсы России*
- •Глава 4 гидрология ледников
- •Происхождение ледников и их распространение на земном шаре
- •Типы ледников
- •Образование и строение ледников
- •Питание и абляция ледников, баланс льда и воды в ледниках
- •Режим и движение ледников
- •Роль ледников в питании и режиме рек. Практическое значение горных ледников
- •Глава 5 гидрология подземных вод
- •Происхождение подземных вод и их распространение на земном шаре
- •Физические и водные свойства грунтов. Виды воды в порах грунтов
- •Физические свойства грунтов
- •Виды воды в порах грунта
- •5.2.3. Водные свойства грунтов
- •Классификация подземных вод. Типы подземных вод по характеру залегания
- •Воды зоны аэрации. Почвенные воды, верховодка, капиллярная зона
- •Воды зоны насыщения. Грунтовые воды
- •5.3.5. Другие типы подземных вод
- •Движение подземных вод
- •Водный баланс и режим подземных вод
- •Водный баланс подземных вод
- •5.5.2. Водный режим зоны аэрации
- •Режим грунтовых вод
- •Провинции: а — кратковременного питания, б— сезонного питания, в — круглогодичного питания (I—XII — месяцы)
- •Взаимодействие поверхностных и подземных вод. Роль подземных вод в питании рек.
- •Практическое значение и охрана подземных вод
- •Глава 6 гидрология рек
- •Реки и их распространение на земном шаре
- •Водосбор и бассейн реки
- •По линии а — б:
- •Сток; 8 — русла рек
- •Морфометрические характеристики бассейна реки
- •Физико-географические и геологические характеристики бассейна реки
- •Река и речная сеть
- •Долина и русло реки
- •Продольный профиль реки
- •Плес; Пр — перекат
- •Питание рек
- •Виды питания рек
- •Классификация рек по видам питания
- •Расходование воды в бассейне реки
- •Водный баланс бассейна реки
- •Уравнение водного баланса бассейна реки
- •Структура водного баланса бассейна реки
- •Водный режим рек
- •Виды колебаний водности рек
- •1 Числитель — данные за 1942—1955 гг., знаменатель — за 1956—1969 гг. 2 Данные за 1941— 1967 гг. 3 Данные за 1968—1987 гг. Прочерк означает отсутствие данных.
- •Фазы водного режима рек. Половодье, паводки, межень
- •Расчленение гидрографа по видам питания
- •Классификация рек по водному режиму
- •Типы: а — дальневосточный (р. Витим, г. Бодайбо, 1937 г.); 6 — тянь-шанский (р. Терек, с. Казбеги,
- •1937 Г.) (I—XII — месяцы)
- •Речной сток
- •Составляющие речного стока
- •Факторы и количественные характеристики стока воды
- •Пространственное распределение стока воды на территории снг
- •Движение воды в реках
- •Распределение скоростей течения в речном потоке
- •Динамика речного потока
- •Закономерности трансформации паводков
- •Движение речных наносов
- •Происхождение, характеристики и классификация речных наносов
- •Частиц, мм 1,0 0,5 0,2 0,1 0,05 0,01 0,005 0,001
- •Движение влекомых наносов
- •Движение взвешенных наносов
- •Сток наносов
- •И связи между ними (б):
- •Русловые процессы
- •Физические причины и типизация русловых процессов
- •Микроформы речного русла и их изменения
- •Мезоформы речного русла и их изменения
- •Макроформы речного русла и их изменения
- •Деформации продольного профиля русла
- •Устойчивость речного русла
- •Термический и ледовый режим рек 6.12.1. Тепловой баланс участка реки
- •Ледовые явления
- •Основные черты гидрохимического и гидробиологического режима рек
- •Гидрохимический режим рек
- •Гидробиологические особенности рек
- •Устья рек
- •Факторы формирования, классификация и районирование устьев рек
- •С блокирующей косой
- •Особенности гидрологического режима устьевого участка реки
- •Особенности гидрологического режима устьевого взморья
- •Практическое значение рек. Влияние хозяйственной деятельности на режим рек
- •Практическое значение рек и типизация хозяйственных мероприятий, влияющих на речной сток
- •Влияние на речной сток хозяйственной деятельности на поверхности речных бассейнов
- •Влияние на речной сток хозяйственной деятельности, связанной с непосредственным использованием речных вод
- •2 4 6 8 1012141618202224 Часы
- •6.15.4. Гидролого-экологические последствия антропогенных изменений стока рек
- •Глава 7 гидрология озер
- •7.1. Озера и их распространение на земном шаре
- •Профиль берега
- •Водный баланс озер
- •Уравнение водного баланса озера
- •Структура водного баланса озера
- •Водообмен в озере
- •Колебания уровня воды в озерах
- •Термический и ледовый режим озер
- •Тепловой баланс озер
- •Термическая классификация озер
- •Термический режим озер в условиях умеренного климата
- •Ледовые явления на озерах
- •Основные особенности гидрохимических и гидробиологических условий. Донные отложения озер
- •Гидрохимические характеристики озер
- •Гидробиологические характеристики озер
- •Наносы и донные отложения в озерах
- •Водные массы озер
- •Изменения гидрологического режима каспийского и аральского морей
- •Проблемы, связанные с судьбой Каспийского и Аральского морей
- •Каспийское море
- •Влияние озер на речной сток. Хозяйственное использование озер
- •Глава 8 гидрология водохранилищ
- •Назначение водохранилищ и их размещение на земном шаре
- •Типы водохранилищ
- •Основные характеристики водохранилищ
- •Водный режим водохранилищ
- •Термический и ледовый режим водохранилищ
- •Гидрохимический и гидробиологический режим водохранилищ
- •Заиление водохранилищ и переформирование их берегов
- •Водные массы водохранилищ
- •Влияние водохранилищ на речной сток и окружающую природную среду
- •Глава 9 гидрология болот
- •Происхождение болот и их распространение на земном шаре
- •Типы болот
- •Строение, морфология и гидрография торфяных болот
- •Развитие торфяного болота
- •Фазы: 7 —низинная; 2—переходная; 3— 6— верховая;
- •Водный баланс и гидрологический режим болот
- •Влияние болот и их осушения на речной сток. Практическое значение болот
- •Глава 10 гидрология океанов и морей
- •Мировой океан и его части. Классификация морей
- •Происхождение, строение и рельеф дна мирового океана. Донные отложения
- •Происхождение ложа океана
- •Рельеф дна Мирового океана
- •Донные отложения
- •Водный баланс мирового океана
- •Солевой состав и соленость вод океана
- •Солевой состав вод океана
- •Распределение солености в Мировом океане
- •Термический режим мирового океана
- •Тепловой баланс Мирового океана
- •Распределение температуры в Мировом океане
- •2,7 3,8 5,5 4,4 2,9 2,2 Южное полушарие
- •Факторы, определяющие плотность морской воды
- •Распределение плотности в Мировом океане
- •Морские льды
- •Ледообразование в море
- •Физические свойства морского льда
- •Движение льдов
- •10.7.4. Ледовитость океанов и морей
- •Оптические свойства морской воды
- •Акустические свойства морской воды
- •Волны зыби
- •Деформация волн у берега
- •Волны цунами
- •Внутренние волны
- •Приливы
- •Основные элементы приливов
- •Приливообразующая сила
- •Статическая и динамическая теории приливов. Строение приливной волны и приливные течения
- •Разложение уравнения приливной волны. Гармонические постоянные. Таблицы приливов
- •Приливы в ограниченном водоеме. Сейши
- •Морские течения
- •10.12.1. Силы, формирующие течения. Классификация морских течений
- •Теория ветровых течений
- •Течение
- •Плотностные течения
- •Циркуляция вод в Мировом океане
- •Уровень океанов и морей
- •Кратковременные колебания уровня
- •Сезонные колебания уровня
- •Водные массы океана
- •Основы учения о водных массах
- •Основы г, s-анализа водных масс
- •Водные массы Мирового океана
- •Взаимодействие океана и атмосферы. Океан и климат
- •Ресурсы мирового океана и его экологическое состояние
- •Ресурсы Мирового океана
- •Литература Основная
- •Богословский б. Б. И др. Общая гидрология,— ji.: Гидрометеоиздат, 1984,—356 с.
- •VI Всероссийский гидрологический съезд. 28 сентября — 1 октября 2004 г. Санкт- Петербург. Тезисы докладов. СПб.: Гидрометеоиздат, 2004.
- •Типы рек
1.3. Физические свойства воды 1.3.1. Агрегатные состояния воды и фазовые переходы
Вода может находиться в трех агрегатных состояниях, или фазах,— твердом (лед), жидком (собственно вода), газообразном (водяной пар). Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (02, N2, С02 и т. д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
Зависимость агрегатного состояния воды от давления и температуры выражается диаграммой состояния воды, или фазовой диаграммой (рис. 1.3).
Кривая ВВ'О на рис 1.3 носит название кривой плавления. При переходе через эту кривую слева направо происходит плавление льда, а справа налево —ледообразование (кристаллизация воды). Кривая О К называется кривой парообразования. При переходе через эту кривую слева направо наблюдается кипение воды, а справа налево — конденсация водяного пара. Кривая АО носит название кривой сублимации, или кривой возгонки. При пересечении ее слева направо происходит испарение льда (возгонка), а справа налево — конденсация в твердую фазу (или сублимация).
В точке О (так называемой тройной точке, при давлении 610 Па и температуре 0,01 °С или 273,160 К) вода одновременно находится во всех трех агрегатных состояниях.
Рис.
1.3. Диаграмма состояния воды /—
VIII
— различные модификации льда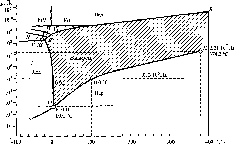
Температура, при которой происходит плавление льда (или кристаллизация воды), называется температурой или точкой плавления ТПЛ. Эту температуру можно называть также температурой или точкой замерзания Гзам.
С поверхности воды, а также льда и снега постоянно отрывается и уносится в воздух некоторое количество молекул, образующих молекулы водяного пара. Одновременно с этим часть молекул водяного пара возвращается обратно на поверхность воды, снега и льда. Если преобладает первый процесс, то идет испарение воды, если второй — конденсация водяного пара. Регулятором направленности и интенсивности этих процессов служит дефицит влажности — разность парциального давления водяного пара в состоянии насыщения (максимально возможного) при данной температуре поверхности воды (снега, льда) и парциального давления фактически содержащегося в воздухе водяного пара. Содержание в воздухе насыщенного водяного пара и его давление увеличиваются с ростом температуры (при нормальном давлении) следующим образом. При температуре О °С содержание и давление насыщенного водяного пара равны соответственно 4,856 г/м 3 и 6,1078 гПа, при температуре 20 °С — 30,380 г/м3 и 23,373 гПа, при 40 °С — 51,127 г/м3 и 73,777 гПа.
Испарение с поверхности воды (льда, снега), а также влажной почвы идет при любой температуре и тем интенсивнее, чем больше дефицит влажности. С ростом температуры упругость водяного пара, насыщающего пространство, растет, и испарение ускоряется.
К увеличению испарения приводит и возрастание скорости движения воздуха над испаряющей поверхностью (т. е. скорости ветра в природных условиях), усиливающее интенсивность вертикального массо- и теплообмена.
Когда интенсивное испарение охватывает не только свободную поверхность воды, но и ее толщу, где испарение идет с внутренней поверхности образующихся при этом пузырьков, начинается процесс кипения. Температура, при которой давление насыщенного водяного пара равно внешнему давлению, называется температурой или точкой кипения ТКИП.
При нормальном атмосферном давлении (1,013 • 105Па = 1,013 бар = = 1 атм = 760 мм рт. ст.) точки замерзания воды (плавления льда) и кипения (конденсации) соответствуют 0 и 100 °С.
Заметим попутно, что характерные точки на диаграмме состояния воды явились основой для шкал температуры. Основой шкалы Цельсия стали принятые за 0 и 100 ° температуры 7"им (или Тт) и Гкип при нормальном давлении. Один градус Цельсия — это 1/100 этого диапазона температуры. За ноль шкалы Кельвина (абсолютный ноль) принята температура на 273,16 °С ниже температуры тройной точки. При этом цены деления в шкалах Цельсия и Кельвина одинаковые.
Температура замерзания Гзам и температура кипения воды Ткт зависят от давления (см. рис. 1.3). В диапазоне изменения давления от 610 до 1,013 • 105 Па температура замерзания немного понижается (от 0,01 до 0 °С), затем при росте давления приблизительно до 6 • 107 Па Тшм падает до -5 °С. Последнее означает, что лед в нижней части толщи ледника, находящийся под давлением, может таять даже при небольшой отрицательной температуре. При увеличении давления до 2,2-108Па Тзш уменьшается до -22 °С. При дальнейшем увеличении давления Тзш начинает быстро возрастать. При очень большом давлении образуются особые «модификации» льда (II—VIII), отличающиеся по своим свойствам от обычного льда ( I).
При реальном атмосферном давлении на Земле пресная вода замерзает при температуре около 0 °С. На максимальных глубинах в океане (около 11 км) давление превышает 10 8 Па (увеличение глубины на каждые Юм увеличивает давление приблизительно на 105 Па). При таком давлении температура замерзания пресной воды была бы около -12 °С.
На снижение температуры замерзания воды оказывает влияние ее соленость (рис. 1.4). Увеличение солености на каждые 10 %о при атмосферном давлении снижает Тзш приблизительно на 0,54 °С:
Гзам =-0,0545. (1.3)
Температура кипения с уменьшением давления снижается (см. рис. 1.3). Поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100 °С. При росте давления Ткци возрастает
Рис.
1.4. Зависимость температуры замерзания
Тзш
(7) и температуры наибольшей плотности
Гнаи6л1л (2)
от солености S
(график Хелланд-Хансена)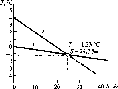
до так называемой «критической точки», когда при р = 2,2-107 Па и Гкип = 374 °С вода одновременно имеет свойства и жидкости, и газа.
Диаграмма состояния воды иллюстрирует две «аномалии» воды, оказывающие решающее влияние не только на «поведение» воды на Земле, но и на природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в Периодической таблице Менделеева в одном ряду с кислородом,— теллуром Те, селеном Se и серой S,—температура замерзания и кипения воды оказывается необычно высокой. Учитывая закономерную связь температуры замерзания и кипения с массовым числом упомянутых веществ, следовало бы ожидать у воды значения температуры замерзания около -90 °С, а температуры кипения около -70 °С.
Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и в жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле. Да и сам облик нашей планеты (огромный Мировой океан, обширные ледники, реки и озера) есть следствие этих особенностей свойств воды.
Земля, по-видимому, единственная планета в Солнечной системе, где вода находится в жидком состоянии. Диаграмма состояния воды (см. рис. 1.3) — универсальна и может быть использована для оценки возможности присутствия воды в жидком виде (а значит — и жизни) в масштабах всей Вселенной. Так, например, на Марсе в условиях очень низких температур (менее -100 °С) и очень малого атмосферного давления (от 1 до 12 гПа, т. е. в среднем в 160 раз меньше, чем на поверхности Земли) вода может находиться лишь в виде льда и частично — водяного пара. Впрочем, в далеком прошлом, когда у Марса была атмосфера, и благодаря парниковому эффекту температура на поверхности планеты была выше, чем сейчас, здесь вполне могла присутствовать жидкая вода, могли выпадать дожди и течь реки. На Венере, наоборот, в условиях очень высоких температур (более 400 °С) и очень большого давления вода может находиться лишь в виде сильно нагретого водяного пара.
