
- •1. Понятие об электродном потенциале. Равновесный электродный потенциал.
- •2. Гальванический элемент Якоби-Даниэля.
- •3. Газовые электроды: водородный, кислородный
- •4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
- •5. Водородный электрод. Стандартные потенциалы металлов.
- •6. Ряд напряжений металлов. Уравнение Нернста.
- •7. Концентрационный гальванический элемент.
- •8. Окислительно-восстановительные г.Э.
- •9. Поляризация электродов в г.Э.
- •10. Понятие об электролизе. Электролиз расплавов солей.
- •11. Электролиз водных растворов солей.
- •12. Поляризация электродов при электролизе. Потенциал разложения.
- •13. Электролиз с растворимыми анодами.
- •14. Электрохимическое рафинирование металлов.
- •15. Практическое применение электролиза.
- •16. Влияние кислотности среды на процесс коррозии.
- •17. Устройство и принцип действия свинцового аккумулятора.
- •18. Устройство и принцип действия сухого марганцево-цинкового элемента.
- •19. Устройство и принцип действия щелочных аккумуляторов.
- •20. Химическая и электрохимическая коррозия металлов.
- •21. Коррозия металлов в кислой и нейтральной среде.
- •22. Коррозия технического железа.
- •23. Электрохимическая коррозия при контакте двух металлов.
- •27. Диэлектрики и полупроводники.
- •28. Полупроводники примесного типа.
- •29. Собственные полупроводники.
- •30. Закон сохранения энергии. Энтальпия системы.
- •31. Закон Гесса. Термодинамические уравнения.
- •32. Энтропия и её изменение при химических процессах.
- •33. Энергия Гиббса и энергия Гельмгольца.
- •34. Связь между различными термодинамическими функциями.
- •35. Скорость гомогенных химических реакций.
- •36. Молекулярность и порядок реакций. Константа скорости реакции первого порядка.
- •37. Скорость гетерогенных химических реакций.
- •38. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аррениуса.
- •39. Энергия активации химических реакций.
- •40. Химическое равновесие, константа равновесия, её связь с термодинамическими функциями.
- •41. Смещение химического равновесия. Принцип Ле-Шателье.
- •42. Зонная теория кристаллов.
- •43. Типы и свойства кристаллов.
- •44. Строение кинофотоматериалов.
- •45. Химизм основных стадий фотографического процесса.
- •46. Связь между различными термодинамическими функциями.
- •47. Структура и свойства полимеров.
- •48. Химические свойства полимеров.
- •49. Материалы на основе полимеров.
- •50. Методы получения полимеров.
1. Понятие об электродном потенциале. Равновесный электродный потенциал.
Электродный потенциал (φ) – разность зарядов между раствором и металлической пластиной (потенциал электрода)

если металлическую пластину погрузить в водный раствор соли металла, то происходит взаимодействие полярных молекул воды с поверхностными атомами металла. В результате часть атомов металла в виде ионов перейдет в раствор, раствор зарядится положительно, а на поверхности металлической пластины будут скапливаться свободные электроны. В результате пластина приобретает отрицательный заряд.
![]() (1)
(1)
Чем больше атомов металла перейдет в раствор, тем больше φ. Однако часть ионов металла способна подходить к поверхности металлической пластины, принимать там электроны и превращаться в металл, поэтому уравнение (1) обратимо. φ, определенный в условиях равновесия уравнения (1) называется равновесным электродным потенциалом.
Если к металлической пластине подключить проводник и отводить электроны, то равновесие сместится в сторону. Если в раствор добавить ионы металла (например, соль), то равновесие сместится в левую сторону.
2. Гальванический элемент Якоби-Даниэля.

водный раствор полупроницаемая перегородка сульфата меди (*)
![]()
![]() ,
то
при замыкании внешней цепи равновесие
в реакции (2) сместится вправо, а в реакции
(1) – влево. Следовательно, в Г. Э. будут
протекать следующие реакции:
,
то
при замыкании внешней цепи равновесие
в реакции (2) сместится вправо, а в реакции
(1) – влево. Следовательно, в Г. Э. будут
протекать следующие реакции:
![]()
В электрохимии принято считать электрод, на котором происходит процесс окисления анодом (А(-)), а электрод, на котором происходит восстановление – катодом (К (+)). Электрод с меньшим значением φ – анод. В любом Г. Э. протекают 4 процесса: 1) окисление на аноде 2) восстановление на катоде 3) движение электронов во внешней цепи от анода к катоду 4) движение ионов через полупроницаемую перегородку
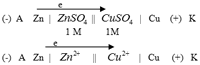
3. Газовые электроды: водородный, кислородный
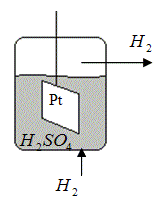
Водородный электрод (стандартный). Сосуд, в который впаян платиновый электрод, покрытый черненой платиной, погружен в раствор 2х молярной серной кислоты с CH+=1 М. В нижнюю часть сосуда подается поток чистого водорода при давлении 1 атм. Часть водорода абсорбируется на платиновой пластине. Абсорбированный водород переходит в раствор в виде ионов H+, а на платиновой пластине остается избыток е, раствор заряжается положительно, а платиновая пластина - отрицательно. Возникает электродный потенциал, величину которого принимают равным 0.
Кислородный электрод устроен аналогично водородному, но вместо H2SO4 используется KOH (COH=1 М) и вместо потока водорода подается поток кислорода (pO2=1 атм).
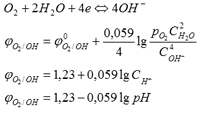
4. Эдс гальванического элемента. Связь эдс с энергией Гиббса
ЭДС гальванического элемента (Е) – максимальная разность потенциалов, которая может возникнуть в нём.
![]()
1 закон Фарадея: масса вещества, выделившегося на электроде прямо пропорциональна количеству прошедшего электричества. 12 – экв - F Для электрохимии превращения 12 – экв вещества требуется затратить 1 Фарадей электричества. 1 моль – nF (n – количество грамм-эквивалентов вещества в 1 моле) Максимальная электрическая работа равна произведению разности потенциалов на количество прошедшего электричества.
![]()
Максимальная полезная работа в изобарном процессе равна изменению энергии Гиббса
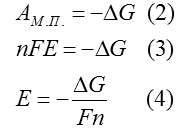
Потенциал зависит от концентрации ионов в растворе
Уравнение Тенгофа:
![]()
aA+bB <=> mM+nN, a, b, m, n – стехиометрические коэффициенты уравнений реакций.
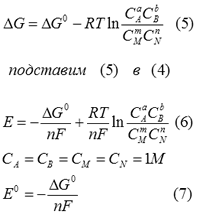
(7) - стандартная ЭДС гальванического эелемента. (7) подставим в (6)

