
- •1. Теплота и работа. Первое начало термодинамики.
- •2. Первое начало термодинамики при изохорическом, изобарическом и изотермическом процессах.
- •3. Теплоёмкость тела и вещества.
- •4. Адиабатический процесс. Уравнение Пуассона.
- •5. Политропические процессы.
- •6. Второе начало термодинамики. Обратимые и необратимые термодинамические процессы.
- •7. Круговой процесс. Тепловые и холодильные машины.
- •8. Идеальная тепловая машина Карно и её кпд.
- •9.Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики. Теорема Нернста.
- •10. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
- •11. Экспериментальные изотермы реального газа. Опыт Эндрюса.
- •1 2. Понятие фазовых переходов. Критические параметры и их связь с поправками Ван-дер-Ваальса.
- •13. Внутренняя энергия реального газа.
- •14. Эффект Джоуля-Томпсона.
- •15. Электрический заряд. Свойства электрического заряда. Закон сохранения электрического заряда. Закон Кулона.
- •16. Электростатическое поле. Напряженность электростатического поля. Силовые линии. Принцип суперпозиции электростатических полей.
- •17. Поток вектора напряженности электростатического поля. Теорема Гаусса для электростатического поля в вакууме в интегральной и дифференциальной формах.
- •18. Работа по перемещению электрического заряда в электростатическом поле.
- •19. Теорема о циркуляции вектора напряженности электростатического поля в интегральной и дифференциальной формах.
- •20. Потенциал. Разность потенциалов. Принцип суперпозиции для электростатических потенциалов.
- •22. Электрический диполь. Электрический момент диполя. Напряженность и потенциал поля диполя.
- •23. Диполь во внешних однородном и неоднородном электростатических полях. Энергия диполя во внешнем электростатическом поле.
- •26. Вектор поляризации. Диэлектрическая восприимчивость полярных и неполярных диэлектриков.
- •27. Теорема Гаусса для электростатического поля в диэлектрике. Вектор электрического смещения.
- •28. Диэлектрическая проницаемость среды. Условия на границе раздела двух диэлектрических сред.
- •29. Сегнетоэлектрики. Диэлектрический гистерезис. Температура Кюри.
- •30. Электрическое поле внутри проводника и вблизи его поверхности. Электростатическая защита.
- •31. Электроемкость уединенного проводника и конденсатора. Электроемкость уединенного проводящего шара.
- •32. Конденсаторы (плоский, сферический, цилиндрический) и их соединения.
- •33. Энергия системы зарядов, проводника и конденсатора. Объемная плотность энергии электрического поля.
- •34. Условия существования и характеристики постоянного электрического тока.
- •35. Законы Ома в интегральной и дифференциальной формах.
- •36. Работа и мощность тока. Закон Джоуля-Ленца в интегральной и дифференциальной формах.
- •37. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции.
- •38. Принцип суперпозиции магнитных полей. Закон Био-Савара-Лапласа.
- •39. Расчет магнитных полей прямого проводника с током бесконечной и конечной длины.
- •40. Магнитное поле движущегося электрического заряда.
- •41. Циркуляция вектора магнитной индукции. Теорема и циркуляции вектора магнитной индукции в вакууме в интегральной и дифференциальной форме.
- •42. Магнитное поле тороида и соленоида.
- •43. Магнитный поток. Теорема Гаусса для магнитного поля в интегральной и дифференциальной формах.
- •44. Сила Ампера. Взаимодействие параллельных проводников с током.
- •45. Магнитный момент контура с током. Механический момент, действующий на контур с током в однородном магнитном поле.
- •46. Работа перемещения проводника и контура с током в магнитном поле.
- •47. Сила Лоренца. Масс-спектрометрия.
- •48. Эффект Холла.
- •49. Опыты Фарадея. Закон электромагнитной индукции. Вихревое электрическое поле. Токи Фуко.
- •50. Явление самоиндукции. Индуктивность.
- •51. Энергия контура с током. Энергия и объёмная плотность энергии магнитного поля.
- •52. Атом в магнитном поле. Магнитные моменты электронов и атомов. Орбитальный и спиновой магнитные моменты.
- •53. Намагниченность. Микротоки и макротоки. Магнитная восприимчивость и магнитная проницаемость среды.
- •54. Типы магнетиков. Магнитная восприимчивость диамагнетиков и парамагнетиков.
- •55. Элементарная теория диа- и парамагнетизма.
- •56. Ферромагнетики. Магнитный гистерезис. Точка Кюри.
- •57. Вихревое электрическое поле. Ток смещения. Первое и второе уравнения Максвелла в интегральной форме.
- •58. Полная система уравнений Максвелла для электромагнитного поля в интегральной и дифференциальной формах. Материальные уравнения. Граничные условия.
- •59. Электромагнитные волны. Волновое уравнение. Основные свойства электромагнитной волны.
- •60. Энергия электромагнитной волны. Вектор Умова — Пойнтинга.
- •61. Интенсивность света при суперпозиции двух монохроматических волн. Интерференция света.
- •62. Время и длина когерентности. Способы получения когерентных волн.
- •6 3. Интерференция света на тонких пленках. Интерференционные приборы.
- •64. Явление дифракции света и условия её наблюдения. Принцип Гюйгенса-Френеля.
- •65. Метод зон Френеля.
- •66. Дифракция Френеля на круглом отверстии и диске.
- •67. Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •68. Дифракция рентгеновских лучей на кристаллической решетке.
- •69. Спектральные приборы. Разрешающая способность оптических приборов.
- •70. Естественный и поляризованный свет. Поляризация света при отражении и преломлении. Закон Брюстера.
- •71. Двойное лучепреломление. Поляризаторы. Закон Малюса.
9.Понятие об энтропии. Энтропия идеального газа. Статистическое истолкование второго начала термодинамики. Теорема Нернста.
Кроме
внутренней энергии U,
которая
является однозначной функцией параметров
состояния системы T
и
V,
в
термодинамике широко используются и
другие функции состояния (свободная
энергия, энтальпия, энтропия и т. д.).
Энтропия
как
функция состояния выделяется среди
других термодинамических функций тем,
что имеет статистическую,
т. е.
вероятностную, природу.
В
термодинамике понятие энтропия
вводится
с помощью приведенного количества
теплоты Q*.
В
изотермическом процессе
Q*
= Q/T.
Если
температура не постоянна (Т
const),
то произвольный процесс нужно разбить
на бесконечно малые участки, где
температуру можно считать постоянно,
и ввести элементарное приведенное
количество теплоты
Q*
= Q/Т.
Приведенная
теплота на конечном участке 1−2
этого процесса
будет определяться интегралом:
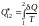 .
Для
любого обратимого
цикла:
.
Для
любого обратимого
цикла:
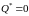
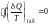 .
Отсюда
следует, что подынтегральное выражение
(Q/T)o6p
является
полным дифференциалом некоторой функции
S,
которую
называют энтропией.
Таким
образом, для обратимого процесса
изменение энтропии определяется
выражениями dS
=
.
Отсюда
следует, что подынтегральное выражение
(Q/T)o6p
является
полным дифференциалом некоторой функции
S,
которую
называют энтропией.
Таким
образом, для обратимого процесса
изменение энтропии определяется
выражениями dS
=
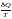
 .
Энтропия
как функция состояния системы обладает
уникальным свойством: энтропия
замкнутой системы при любых происходящих
в ней процессах не может убывать. Она
остается постоянной в обратимых процессах
и возрастает в необратимых. Следовательно,
имеет место закон
возрастания энтропии:
S
0. − статистическая
формулировка второго начала термодинамики.
Больцман
показал, что энтропия S
пропорциональна
логарифму вероятности состояния: S
= k
lnW,
где
k
– постоянная Больцмана; W
– вероятность данного состояния.
.
Энтропия
как функция состояния системы обладает
уникальным свойством: энтропия
замкнутой системы при любых происходящих
в ней процессах не может убывать. Она
остается постоянной в обратимых процессах
и возрастает в необратимых. Следовательно,
имеет место закон
возрастания энтропии:
S
0. − статистическая
формулировка второго начала термодинамики.
Больцман
показал, что энтропия S
пропорциональна
логарифму вероятности состояния: S
= k
lnW,
где
k
– постоянная Больцмана; W
– вероятность данного состояния.
Изменение
энтропии идеального газа. Найдем
изменение энтропии идеального газа при
любом произвольном процессе
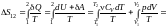
 .
(12.10.10)
.
(12.10.10)
Третье
начало термодинамики
(или теорема
Нернста)
было открыто в 1906 г.
В. Нернст
в процессе термодинамического исследования
изменения энтропии химических реакций.
Оно тесно связано с поведением теплоемкости
при абсолютном нуле температур. Теорема
Нернста утверждает,
что при приближении к абсолютному нулю
энтропия системы также стремится к нулю
независимо от того, какие значения
принимают все остальные параметры
состояния системы:
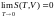 .
Поскольку
энтропия равна
.
Поскольку
энтропия равна
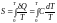 ,
а
температура Т
стремится
к нулю,
теплоемкость
вещества также должна стремиться к
нулю, причем быстрее, чем Т.
Отсюда
следует недостижимость
абсолютного нуля температуры при
конечной последовательности
термодинамических процессов, т. е.
конечного числа операций −
циклов работы холодильной машины.
,
а
температура Т
стремится
к нулю,
теплоемкость
вещества также должна стремиться к
нулю, причем быстрее, чем Т.
Отсюда
следует недостижимость
абсолютного нуля температуры при
конечной последовательности
термодинамических процессов, т. е.
конечного числа операций −
циклов работы холодильной машины.
10. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
Между
ат. и мол-ми вещества на малых расстояниях
действуют силы отталкивания Fo ,
а на больших − силы притяжения Fп.
В случае простых неполярных веществ
притяжение в основном обусловлено
взаимодействием наведенных дипольных
моментов молекул. Эти сравнительно
слабые ван-дер-ваальсовы
силы
зависят
от расстояния r
между
молекулами по степенному закону (F
r−n).
Область их действия порядка 10−9
м. Для двух молекул простых веществ
явный вид потенциальной энергии Ф(r)
взаимодействия, которое описывается
потенциалом Леннарда −
Джонса, имеет вид
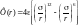 .
Значения величин
и
- в справочнике. Наличие сил притяжения
и отталкивания приводит к тому, что при
больших давлениях поведение реального
газа будет отличаться от модели идеального
газа. Одно из наиболее известных
приближенных уравнений описывающих
состояние реального газа было предложено
голландским физиком Ван-дер-Ваальсом
- базируется на законе Менделеева − Клапейрона
и содержит два параметра (а
и b),
с помощью которых учитывается вклад
сил притяжения на больших расстояниях
и сил отталкивания на малых расстояниях
между молекулами реального газа.
Силы
отталкивания противодействуют
проникновению данной частицы в ту
область объема сосуда, которая занята
другими молекулами. Собственный объем
V0 ,
занятый
частицей, представляется как объем шара
с некоторым эффективным диаметром d.
Поэтому «свободный
объем»
V *,
в
котором могут свободно (как в идеальном
газе) двигаться молекулы реального
газа, будет на некоторую величину меньше,
чем объем V,
занимаемый
газом. «Свободный
объем»
будет равен
V *
= V
− b,
где b
−
поправочный коэффициент для одного
моля газа.
Приближенные
расчеты показывают, что объем, занятый
молекулой, равен учетверенному
собственному объему этой молекулы V0 .
Тогда поправка b
равна
b
= 4Na V0 .
Наличие
сил притяжения между молекулами приводит
к дополнительному «внутреннему» давлению
рi,
которое
оказывается обратно пропорциональным
квадрату V
.
Значения величин
и
- в справочнике. Наличие сил притяжения
и отталкивания приводит к тому, что при
больших давлениях поведение реального
газа будет отличаться от модели идеального
газа. Одно из наиболее известных
приближенных уравнений описывающих
состояние реального газа было предложено
голландским физиком Ван-дер-Ваальсом
- базируется на законе Менделеева − Клапейрона
и содержит два параметра (а
и b),
с помощью которых учитывается вклад
сил притяжения на больших расстояниях
и сил отталкивания на малых расстояниях
между молекулами реального газа.
Силы
отталкивания противодействуют
проникновению данной частицы в ту
область объема сосуда, которая занята
другими молекулами. Собственный объем
V0 ,
занятый
частицей, представляется как объем шара
с некоторым эффективным диаметром d.
Поэтому «свободный
объем»
V *,
в
котором могут свободно (как в идеальном
газе) двигаться молекулы реального
газа, будет на некоторую величину меньше,
чем объем V,
занимаемый
газом. «Свободный
объем»
будет равен
V *
= V
− b,
где b
−
поправочный коэффициент для одного
моля газа.
Приближенные
расчеты показывают, что объем, занятый
молекулой, равен учетверенному
собственному объему этой молекулы V0 .
Тогда поправка b
равна
b
= 4Na V0 .
Наличие
сил притяжения между молекулами приводит
к дополнительному «внутреннему» давлению
рi,
которое
оказывается обратно пропорциональным
квадрату V
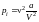 ,
где
a
−
второй поправочный коэффициент. В
результате внешнее давление р,
которое
необходимо приложить к реальному газу
для удержания его в заданном объеме V,
уменьшается
по сравнению с давлением р*
в
случае идеального газа. Это значит, что
,
где
a
−
второй поправочный коэффициент. В
результате внешнее давление р,
которое
необходимо приложить к реальному газу
для удержания его в заданном объеме V,
уменьшается
по сравнению с давлением р*
в
случае идеального газа. Это значит, что
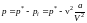 .
Свободный объем V *
и
давление р*
связаны
уравнением Клапейрона – Менделеева
р* V *
=
RT.
Приближенное уравнение состояния для
реального газа
.
Свободный объем V *
и
давление р*
связаны
уравнением Клапейрона – Менделеева
р* V *
=
RT.
Приближенное уравнение состояния для
реального газа
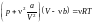 .
Следует отметить, что уравнение
Ван-дер-Ваальса лучше согласуется с
опытными данными, чем уравнение
Клапейрона −Менделеева,
особенно при больших давлениях.
Проведем
анализ уравнения Ван-дер-Ваальса. С этой
целью построим зависимости давления
от объема
газа при
постоянной температуре
для
нескольких значений температуры (Т1
Т2
Тк
Т3
Т4).
Полученные
кривые − изотермы
Ван-дер-Ваальса,
оказываются
довольно
своеобразными: при низких температурах
они имеют волнообразные участки
(максимумы и минимумы), при некоторой
температуре Тк
на
изотерме имеется только точка
перегиба К,
при
высоких температурах изотермы
Ван-дер-Ваальса похожи на изотермы
идеального газа.
С
математической точки зрения такой
характер изотерм объясняется очень
просто. Если привести уравнение
Ван-дер-Ваальса к нормальному виду, то
оно окажется кубическим
уравнением
относительно
объема V.
Кубическое
уравнение может иметь либо три вещественных
корня, либо один вещественный корень и
два мнимых. Очевидно, что первому случаю
соответствуют изотермы при низких
температурах (три значения объема газа
.
Следует отметить, что уравнение
Ван-дер-Ваальса лучше согласуется с
опытными данными, чем уравнение
Клапейрона −Менделеева,
особенно при больших давлениях.
Проведем
анализ уравнения Ван-дер-Ваальса. С этой
целью построим зависимости давления
от объема
газа при
постоянной температуре
для
нескольких значений температуры (Т1
Т2
Тк
Т3
Т4).
Полученные
кривые − изотермы
Ван-дер-Ваальса,
оказываются
довольно
своеобразными: при низких температурах
они имеют волнообразные участки
(максимумы и минимумы), при некоторой
температуре Тк
на
изотерме имеется только точка
перегиба К,
при
высоких температурах изотермы
Ван-дер-Ваальса похожи на изотермы
идеального газа.
С
математической точки зрения такой
характер изотерм объясняется очень
просто. Если привести уравнение
Ван-дер-Ваальса к нормальному виду, то
оно окажется кубическим
уравнением
относительно
объема V.
Кубическое
уравнение может иметь либо три вещественных
корня, либо один вещественный корень и
два мнимых. Очевидно, что первому случаю
соответствуют изотермы при низких
температурах (три значения объема газа
 ,
,
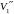 ,
,
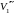 отвечают
одному значению давления p1),
а
второму случаю − изотермы при высоких
температурах (одно значение объема V4
отвечает
одному значению давления р4)
(рис. 13.1.2).
отвечают
одному значению давления p1),
а
второму случаю − изотермы при высоких
температурах (одно значение объема V4
отвечает
одному значению давления р4)
(рис. 13.1.2).
