
- •Гесса закон
- •2.1 Объясните изменение энтропии в процессах
- •Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
- •К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
- •Влияние температуры
- •Факторы влияющие на смещение равновесия химических реакций. Принцип Ле –Шателье
- •Если на систему, находящуюся в равновесии, производится какое- либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Периодическая система элементов д.И. Менделеева
- •Виды химической связи
- •Полярная ковалентная связь
- •Донорно-акцепторная связь
- •Водородные связи
- •Теория растворов электролитов. Сильные и слабые электролиты, основные положения теории сильных электролитов. Закон действия масс
- •Степень диссоциации. Сила электролитов.
- •Закон действия масс
- •Константы диссоциации некоторых слабых электролитов в водных растворах при 25°с
- •Коэффициенты активности ионов f при различных ионных силах раствора
- •Константы диссоциации некоторых сильных кислот в водных растворах при 25 °с
- •Ионно-молекулярные уравнения.
- •Растворимость важнейших солей в воде
- •1.1 Металлические покрытия
- •1.2 Гальванические покрытия.
- •1.3 Термодиффузионный метод покрытия
- •1.4 Горячий метод, или метод погружения в расплавленный металл
- •1.5 Металлизация напылением
- •1.2 Неметаллические покрытия
- •1.2.1 Неорганические покрытия
- •1.2.2 Фосфатирование
- •1.2.3 Пассивирование
- •1.2.1 Эмали
- •1.2.2 Органические покрытия
Виды химической связи
В настоящее время все виды химической связи делят ковалентную, ионную, донорно-акцепторную, ван-дер-ваальсову, водородную, металлическую.
Ковалентная связь образуется, когда два атома могут «обобщить» электроны:
А . + В . → А:В
Ионная связь образуется, когда "обмен "становится настолько неравными, что электрон отрывается от своего атома А и полностью переходит к атому B, в результате чего образуется пара ионов:
А . + В . → А+ :В-
Мы считаем, что ионная связь есть крайний случай такого вида химической связи как ковалентный. подробнее >>
Полярная ковалентная связь
Если нет такого понятия, как "абсолютная ионная "связь, может быть есть полностью ковалентная? Ответ "да". Это случай, когда два ядра притягивают электрон с равным усилием. Это положение гарантируется для гомоядерных двухатомных молекул - молекул, состоящих из двух одинаковых атомов. Таким образом, в Cl2, O2, H2 электроны поделены между двумя одинаковыми атомами поровну. В таких молекулах, в центр положительного заряда, в точности совпадает центром отрицательного заряда - по середине между двумя ядрами. Связывающие электроны находятся в пространстве между связываемыми атомами.
Особенностью ковалентной связи является также ее поляризуемость. Если молекула состоит из двух атомов, которые связаны полярной связью, то такая молекула является полярной молекулой, т.е. представляет собой диполь.

Донорно-акцепторная связь
Другой тип химической связи - донорно-акцепторная. Различают обменный и донорно-акцепторный механизм образования связи. Ковалентная связь, образующаяся по донорно-акцепторному механизму (т.е. за счет пары электронов одного из атомов), называется дoнорно-акцeпторной. Так рассмотренный выше пример с LiF -есть пример донорно-акцептороной связи.
А : + В → А:В
Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия.
Ван-дер-ваальсовы силы
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания (взаимодействие молекул между собой). Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей.
Основу ван-дер-ваальсовых сил также составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.
Рис.1 Ван-дер-ваальсовы силы
Ван-дер-ваальсовы силы заметно уступают любому виду химической связи. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Водородные связи
Водородсодержащие группы атомов (где атом водорода соединен с атомом фтора, кислорода или азота, реже: хлора, серы или других неметаллов) часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такой вид химической связи получил название водородной связи. Это частный случай Ван-дер-ваальсовых сил.
Ковалентные связи H-O, H-F, H-N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах - избыточный отрицательный заряд. Между разноименно заряженными полюсами возникают силы электростатического притяжения - водородные связи. Водородный вид химической связи может быть как межмолекулярным, так и внутримолекулярным. Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.
Одним из признаков этого вида химической связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н ... В больше, чем А-В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе [F-H-F]- энергия водородной связи равна 155 кДж/моль и сопоставима с энергией другого вида связи - ковалентной связью. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
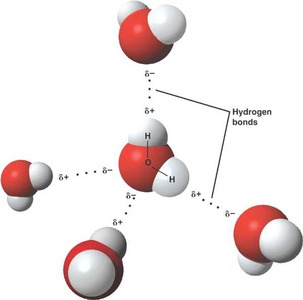
Рис. 2. Водородная связь между молекулами воды
18 - Ковалентная связь.
КОВАЛEНТНАЯ СВЯЗЬ (от лат. со- - приставка, означающая совместность, и valens - имеющий силу), тип химической связи, характеризуемый увеличением электронной плотности в области между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в своб. атомах. Уменьшение энергии системы при образовании К. с. не может быть описано электростатич. моделью и требует учета квантовых св-в молекулы, напр. симметрии многоэлектронной волновой ф-ции относительно перестановок индексов электронов. В рамках классич. теории хим. строения К. с. объясняется как образование электронных пар, общих для связываемых атомов и достраивающих их электронные оболочки в молекуле до замкнутых (с числом электронов 8, 18 и т.д.). Квантовохим. описание К. с. проводят обычно в рамках метода валентных связей (валентных схем) или методов мол. орбиталей. В последнем случае К. с. связывают с мол. орбиталью, локализованной в области, охватывающей неск. (два, три и т.д.) ядер (двухцентровые, трехцентровые и т.д. связи). Такая мол. орбиталь м. б. заполнена одним или двумя электронами. Все электроны молекулы одинаковы, однако обычно считают, что при образовании электронной пары от каждого атома на мол. орбиталь поставляется по одному электрону, и отдельно выделяют случай донорно-акцепторной связи (см. Координационная связь ), когда оба электрона поставляются одним из атомов. В зависимости от числа образующихся для данной К. с. электронных пар говорят об ординарной (простой) и кратных связях (двойной, тройной). Идеальная К. с. существует лишь в гомоядерных системах, напр. Н2, Н+2, Н+3, С2, N2 и т.д. Если атомы в молекуле различны, электронная плотность смещается к одному из ядер атомов, между к-рыми образуется К. с., т. е. происходит поляризация связи. Случаю предельной поляризации отвечает идеальная ионная связь. Характер поляризации К. с. существенно связан с конкретным электронным и колебат. состояниями молекулы. Так, молекула СО при малых межъядерных расстояниях (близких к равновесному) м. б. описана как СО+, а при расстояниях несколько больших равновесного - как С+ О ( - эффективный заряд атома в молекуле). При приближении к диссоциац. пределу стремится к нулю и молекула диссоциирует на нейтральные атомы. Гомоядерная молекула Н2 в возбужденных электронных состояниях может диссоциировать на Н+ и Н- и т. п. Характер поляризации К. с. может меняться при переходе молекулы в к.-л. из ее возбужденных состояний. Сложность этой картины связана с тем, что представление о К. с. (как и об ионной связи) возникло в классич. химии и выделялось не по особенностям электронного распределения, а по специфике хим. поведения молекул при нормальных условиях, когда в осн. заселены низшие электронно-колебат. состояния. Представление о К. с. корректно определено вблизи равновесной конфигурации для тех молекул, у к-рых смещения ядер от положения равновесия малы. Одно из существ. св-в К. с.-ее насыщаемость: при ограниченном числе валентных электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома. Именно это число тесно связано с традиц. понятием валентности атома в молекуле. Др. важное св-во К. с. - ее направленность в пространстве, проявляющаяся в примерно одинаковом геом. строении родственных по составу мол. фрагментов. Напр., фрагмент СН2 в разл. насыщ. углеводородах имеет примерно одно и то же строение. Направленность К. с. часто связывают с гибридизацией атомных орбиталей , из к-рых составляется мол. орбиталь, отвечающая
19 - Ионная связь
Ионная связь, электровалентная связь, гетеровалентная связь, один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами. Такие связи в сравнительно чистом виде образуются в галогенидах щелочных металлов, например KF, так как атомы щелочных металлов имеют по одному слабо удерживаемому электрону (энергия связи примерно 3—5 эв), а атомы галогенов обладают наибольшим сродством к электрону. Но даже в кристаллах (и тем более в молекулах) этих соединений полной передачи электрона от атома металла атому галогена большей частью все же не происходит. Распространенные прежде представления об образовании в другихслучаях двух-, трех- или четырехзарядных ионов Ca2+, C2- , B3+, Si4+не подтвердились, так как химическая связь образуется в таких случаях более сложным путём.Для оценки степени ионности связи пользуются понятием эффективного заряда иона
20 - Направленность, поляризуемость и насыщенность химической связи
Ковалентная
связь
(атомная связь) — химическая связь,
образованная перекрытием (обобществлением)
пары валентных электронных облаков.
Обеспечивающие связь электронные облака
(электроны) называются общей электронной
парой.
![]()
|
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Метод валентных связей (ВС)
Правило октета Льюиса. В 1916 г. английский ученый Д.Льюис предположил, что химическая связь образуется в результате обобществления электронов, принадлежащих до образования связи разным атомам. Согласно правилу октета Льюиса внешняя электронная оболочка каждого из атомов, образующих химическую связь, должна иметь электронную конфигурацию благородного газа (за исключением гелия), т.е. атом должен иметь во внешней оболочке восемь электронов.
В зависимости от числа обобществленных электронных пар связь может быть одинарной, двойной или тройной:
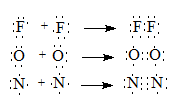
В формулах Льюиса химическая связь изображают парой точек, соответствующих двум электронам. Чаще химическую связь изображают черточками: Br−Br, O=O, N≡N.
Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
21 - Гибридизация орбиталей.
ГИБРИДИЗАЦИЯ
АТОМНЫХ ОРБИТАЛЕЙ
,
квантовохим.
способ описания перестройки орбиталей
атома в молекуле по сравнению со своб.
атомом. Являясь формальным мат. приемом,
Г. а. о. позволяет отразить нарушение
сферич. симметрии распределения
электронной плотности атома при
образовании хим. связи. Сущность Г. а.
о. состоит в том, что электрон молекулы
вблизи выделенного атомного ядра
характеризуется не отдельной атомной
орбиталью (АО), а линейной комбинацией
атомных орбита-лей с разл. значениями
азимутального и магнитного квантовых
чисел. Такая линейная комбинация наз.
гибридной (гибридизированной) орбиталью
(ГО). Как правило, гибридизация затрагивает
лишь высшие и близкие по энергии занятые
АО своб. атома. Напр., для атомов элементов
второго периода периодич. системы
типичная форма ГО![]() -линейная
комбинация 2s-орбитали
-линейная
комбинация 2s-орбитали![]() и
2р-орбиталей
и
2р-орбиталей![]()
![]() ,
,![]()
![]() ,
,![]() с численными коэффициентами
с численными коэффициентами![]() и
и
ГО
обладают более низкой симметрией, чем
составляющие их АО. Так, распределение
электронной плотности, отвечающее
указанной ГО![]() ,
смещено от атомного ядра в направлении
вектора п
с координатами
,
смещено от атомного ядра в направлении
вектора п
с координатами![]() ; вектор п
является
осью симметрии ГО (рис. 1). При изменении
ориентации в пространстве осей координат
коэффициенты линейной комбинации могут
изменяться, однако остается постоянным
отношение сумм квадратов коэффициентов
для данного значения азимутального
квантового числа. Это отношение определяет
тип ГО. Напр., орбиталь
; вектор п
является
осью симметрии ГО (рис. 1). При изменении
ориентации в пространстве осей координат
коэффициенты линейной комбинации могут
изменяться, однако остается постоянным
отношение сумм квадратов коэффициентов
для данного значения азимутального
квантового числа. Это отношение определяет
тип ГО. Напр., орбиталь![]() относится
к типу sapb,
где
а
и
b-
числа,
подобранные так, чтобы
относится
к типу sapb,
где
а
и
b-
числа,
подобранные так, чтобы![]() .
Обычно принимают а
— 1,
b
=
1, 2 или 3.
.
Обычно принимают а
— 1,
b
=
1, 2 или 3.
Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, к-рый называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет Г. а. о. типа sp3, атом С в молекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетич. электронной конфигурации.
Обычно
система ГО строится таким образом, чтобы
для разных орбиталей одного атома
интегралы перекрывания были равны нулю
(см. Молекулярные
интегралы
). Кроме
того, каждая орбиталь в молекуле либо
остается негибридизированной АО, либо
выбирается гибридизированной по
определенному типу. Этим требованиям
удовлетворяют неск. наборов орбиталей.
Напр., атом О в молекуле Н2О
можно считать как sp2-,
так и 5р3-гибридизированным.
Оси симметрии всех орбиталей обычно
образуют симметричную фигуру (см. рис.
2). Операции симметрии этой фигуры
переводят ГО одного атома друг в друга.
Такие ГО наз. эквивалентными. Напр.,
линейная комбинация четырех валентных
АО атома С приводит к четырем 5р3-гибридным
орбиталям, оси симметрии к-рых по
отношению друг к другу расположены под
углом 109,5°, т.е. направлены по углам
тетраэдра (рис. 2, в).
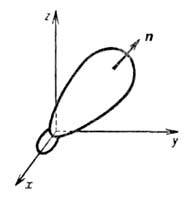
Рис.
1. Гибридная орбиталь, образованная из
2s- и 2р-атомных орбиталей; х, у, z- координатные
оси, п-ось симметрии.
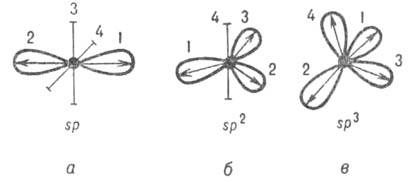
Рис. 2. , 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.
Представление о Г. а. о. используется для изучения закономерностей изменения электронной плотности молекулы вблизи к.-л. атомного ядра в зависимости от его окружения, т.е. позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны разл. подходы к анализу этой связи. Если известно геом. расположение атомных ядер, расчет волновой ф-ции молекулы можно свести к изучению парных взаимод. соседних атомов (см. Валентных связей метод , Молекулярных орбиталей методы ). Для такого расчета выбирают одну из возможных систем ГО и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар ГО разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в к-рых все взаимод. атомов в молекуле учитываются одновременно и волновая ф-ция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае ГО строят после определения волновой ф-ции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной ГО. В обоих подходах тип Г. а. о. обусловлен геом. конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам ГО.
В теоретич. химии для систематизации эксперимент. данных о равновесных конфигурациях молекул часто применяют феноменологич. подход, в рамках к-рого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения. Отклонение конфигурации молекулы от симметричной связывают с взаимод. хим. связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о Г. а. о. используются в стереохимии.
22 - Понятие электролитической диссоциации
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных растворителях.
При
электролитической диссоциации разрываются
обычно лишь наиболее полярные связи
молекул, например карбоновые кислоты
RCOOH диссоциируют на
![]() и
Н+,
электролитической диссоциации могут
подвергаться молекулы некоторых
растворителей, например воды.
и
Н+,
электролитической диссоциации могут
подвергаться молекулы некоторых
растворителей, например воды.
Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации.
Электролитическая диссоциация лежит в основе деления растворов на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных свойствах разбавленных растворов электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в растворе. Это, в частности, приводит к увеличению осмотического давления раствора сравнительнос растворами неэлектролитов, понижению давления пара растворителя над раствором, увеличениюизменения температуры кипения и замерзания раствора относительно чистого растворителя. Электролитической диссоциацией объясняется также ионная электропроводность электролитов.
Мерой
электролитической диссоциации является
степень диссоциации
![]() -
отношение кол-ва диссоциированных на
ионы молекул
электролита к их исходному количеству
в растворе. Согласно этому определению,
-
отношение кол-ва диссоциированных на
ионы молекул
электролита к их исходному количеству
в растворе. Согласно этому определению,
![]() изменяется
от 0 (отсутствие диссоциации) до 1 (полная
диссоциация) и зависит от природы
растворенного вещества и растворителя,
а также от концентрации
раствора и температуры. Как правило, с
увеличением диэлектрической проницаемости
растворителя
изменяется
от 0 (отсутствие диссоциации) до 1 (полная
диссоциация) и зависит от природы
растворенного вещества и растворителя,
а также от концентрации
раствора и температуры. Как правило, с
увеличением диэлектрической проницаемости
растворителя
![]() его
его
![]() увеличивается,
хотя заметная диссоциация наблюдается
в некоторых растворителях с низкой
увеличивается,
хотя заметная диссоциация наблюдается
в некоторых растворителях с низкой
![]()
|
|
Дать объявление |
B2BContext |
|
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Способность
данного вещества MX к электролитическая
диссоциация
в определенном р-рителе по схеме MX
![]() M+
+ Х-
характеризуется константой электролитической
диссоциации KD,
связанной,
согласно закону действующих масс, со
степенью диссоциации
M+
+ Х-
характеризуется константой электролитической
диссоциации KD,
связанной,
согласно закону действующих масс, со
степенью диссоциации
![]() соотношением:
соотношением:

где
х:
- молярная концентрация электролита;
![]() -
средний ионный коэффициент активности;
-
средний ионный коэффициент активности;
![]() -
коэффициент активности недиссоциированной
части электролита. Как и
-
коэффициент активности недиссоциированной
части электролита. Как и
![]() значение
константы KD
зависит
от свойств растворенного вещества, в
частности от прочности связи между
фрагментами молекул
электролита, образующими катион и анион,
от диэлектрических свойств растворителя,
его способности сольватировать ионы,
а также от температуры и давления; в
отличие от
значение
константы KD
зависит
от свойств растворенного вещества, в
частности от прочности связи между
фрагментами молекул
электролита, образующими катион и анион,
от диэлектрических свойств растворителя,
его способности сольватировать ионы,
а также от температуры и давления; в
отличие от
![]() не
зависит от концентрации
раствора. Константа KD
может
быть определена экспериментально,
например, по зависимости электропроводности
раствора от концентрации электролита
или путем прямого измерения содержания
свободных ионов
в растворе, например, спектрофотометрическим
методом.
не
зависит от концентрации
раствора. Константа KD
может
быть определена экспериментально,
например, по зависимости электропроводности
раствора от концентрации электролита
или путем прямого измерения содержания
свободных ионов
в растворе, например, спектрофотометрическим
методом.
Соответственно
понятиям полной и неполной электролитической
диссоциации электролиты классифицируют
на сильные
![]() и
слабые
и
слабые
![]() (см.
Электролиты),
полностью
диссоциируют в растворе многие соли
неорганических кислот, некоторые кислоты
и основания. Неполная электролитическая
диссоциация наблюдается для солей,
катионы
которых склонны к образованию ковалентных
связей с анионами, например соли Ag, Cd,
Zn. Некоторые многоосновные кислоты,
например H2SO4,
полностью диссоциируют лишь в отношении
отщепления одного иона Н+,
а дальнейшая диссоциация
(см.
Электролиты),
полностью
диссоциируют в растворе многие соли
неорганических кислот, некоторые кислоты
и основания. Неполная электролитическая
диссоциация наблюдается для солей,
катионы
которых склонны к образованию ковалентных
связей с анионами, например соли Ag, Cd,
Zn. Некоторые многоосновные кислоты,
например H2SO4,
полностью диссоциируют лишь в отношении
отщепления одного иона Н+,
а дальнейшая диссоциация
![]() затруднена.
Разбавленные растворы слабых электролитов
по своим свойствам близки к идеальным
растворам, для них в формуле (1) коэффициент
активности можно считать равными 1.
Тогда формула (1) переходит в закон
разведения Оствальда:
затруднена.
Разбавленные растворы слабых электролитов
по своим свойствам близки к идеальным
растворам, для них в формуле (1) коэффициент
активности можно считать равными 1.
Тогда формула (1) переходит в закон
разведения Оствальда:

в
котором а можно заменить отношением
![]() где
где
![]() и
и
![]() -соответственно
эквивалентная электропроводность
раствора при данной концентрации
и при бесконечном разведении. В
соответствии с законом Оствальда с
уменьшением концентрации раствора
степень диссоциации
а и эквивалентная электропроводность
возрастают, причем при бесконечном
разведении
-соответственно
эквивалентная электропроводность
раствора при данной концентрации
и при бесконечном разведении. В
соответствии с законом Оствальда с
уменьшением концентрации раствора
степень диссоциации
а и эквивалентная электропроводность
возрастают, причем при бесконечном
разведении
![]() и
и
![]() .
Растворы сильных электролитов
не являются идеальными и для их описания
необходим учет межионного взаимодействия
даже в области предельного разведения.
При определенных условиях, например в
растворителях с малой диэлектрической
проницаемостью, при низких температурах
или при образовании многовалентных
ионов, благодаря сильному электростатическому
притяжению противоположно заряженных
ионов
могут образовываться ионные ассоциаты,
простейшими из которых являются ионные
пары.
.
Растворы сильных электролитов
не являются идеальными и для их описания
необходим учет межионного взаимодействия
даже в области предельного разведения.
При определенных условиях, например в
растворителях с малой диэлектрической
проницаемостью, при низких температурах
или при образовании многовалентных
ионов, благодаря сильному электростатическому
притяжению противоположно заряженных
ионов
могут образовываться ионные ассоциаты,
простейшими из которых являются ионные
пары.
Равновесие между сольватированными ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной - константой ассоциации. В приближении электростатического взаимодействия между ионами константа диссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, может быть рассчитана по формуле:
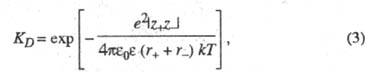
где
е
- элементарный
электрический заряд; k
- постоянная
Больцмана;
![]() -
электрическая постоянная (диэлектрическая
проницаемость вакуума) ;
-
электрическая постоянная (диэлектрическая
проницаемость вакуума) ;
![]() -
диэлектрическая проницаемость
растворителя; Т
- абс.
температура.
-
диэлектрическая проницаемость
растворителя; Т
- абс.
температура.
Понятие электролитической диссоциации было введено С. Аррениусом в 1887. Электролитическая диссоциация играет важную роль во многих природных и производств, процессах, определяя как свойства растворов электролитов, так и особенности происходящих в них процессов.
23 - Сильные и слабые электролиты. Степень диссоциации
