
- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
8. Донорные и акцепторные примеси в полупроводниках.
*Акцепторные примеси - атомы химических элементов, внедренные в кристаллическую решетку полупроводника и создающие дополнительную концентрацию дырок. Акцепторными примесями являются химические элементы, внедренные в полупроводник с большей, чем у примеси, валентностью.
*Акцепторные примеси (акцепторы) (от лат. acceptor - - «принимающий») - примесные (чужеродные, специально внесённые в полупроводник) атомы, которые могут захватывать валентные электроны вещества и тем самым создавать дырки. Например, типичные акцепторы для Si и Ge - А1, В. Если в кристалле четырёхвалентного германия (Ge) заместить один атом атомом трёхвалентного индия (In), имеющим три валентных электрона на внешней оболочке, то для образования всех связей в решётке Ge возникнет недостаток одного электрона. Проводимость такого полупроводника будет в основном дырочной. Полупроводники с преобладанием дырочной проводимости называются полупроводниками р-типа (от лат. positivus - «положительный»).
*Донорные примеси - атомы химических элементов:
- внедренные в кристаллическую решетку полупроводника;
и - создающие дополнительную концентрацию свободных электронов.
Донорными примесями являются химические элементы, внедренные в полупроводник с меньшей, чем у примеси, валентностью.
Встроенные в кристаллическую решетку Ge или Si примеси из V группы (P, As, Sb) называются донорными примесями. ΔED – энергия активации донорной примеси – энергия, необходимая для переброски электрона с донорного уровня в зону проводимости.
В запрещенной зоне движение электронов и дырок не возможно. Так как донорный уровень находится в запрещенной зоне, дырка, оставшаяся после переброски электрона в зону проводимости остается неподвижна.
Так как ΔED« ΔЕ0 при комнатной температуре, где ΔЕ0 - ширина запрещенной зоны, то все электроны примесей будут переброшены в зону проводимости.
Акцепторными примесями в полупроводниках IV группы будут являться примеси из элементов III группы (Al, Ga, In)
Атом In образует только три связи с атомами Si, четвертый незанятый уровень находится вблизи валентной зоны на расстоянии ΔEa – энергии активации акцепторной примеси. В запрещенной зоне электрон двигаться не может. При рабочих температурах полупроводниковых приборов большинство акцепторных уровней занято электронами, таким образом обеспечивается дырочная проводимость таких полупроводников.

9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
A и B обозначают различные элементы, а римские цифры их принадлежность к соответствующим группам таблицы Менделеева. AIII – Ga, In, Al BV – P, As, Sb
При увеличении порядкового номера элемента AIII уменьшается температура плавления и ширина запрещенной зоны бинарных полупроводников AIIIBV. Это связано с уменьшением прочности связи и усилением металлических свойств рассматриваемых соединений. Такие полупроводники получают прямым синтезом.
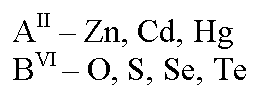
В образовании бинарных полупроводников АIIBVI типа участвуют металлы побочной подгруппы второй группы таблицы Менделеева
Обладают собственной электронно-дырочной проводимостью

