
- •1. Электролитическая диссоциация.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •2. Электролитическая диссоциация воды. Ионное произведение воды.
- •3. Равновесие на границе раствор-электрод. Электрохимические цепи.
- •4. Водородный электрод. Электродные реакции. Электродный потенциал.
- •5. Элемент Якоби-Даниэля. Уравнение Нернста.
- •6. Химическая связь и строение полупроводниковых веществ. Металлы, полупроводники и диэлектрики. Энергетические зоны в металлах, полупроводниках и диэлектриках.
- •7. Собственная проводимость полупроводников. Элементарные полупроводники IV группы
- •8. Донорные и акцепторные примеси в полупроводниках.
- •9. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •10. Бинарные полупроводники aiiibv типа. Бинарные полупроводники аiibvi типа.
- •11. Первый закон термодинамики. Энтальпия.
- •12. Первый закон термодинамики. Закон Гесса.
- •13. Определение теплового эффекта химической реакции
- •14. Второй закон термодинамики. Энтропия
- •17. Второй закон термодинамики. Энтропия как степень беспорядка системы.
- •18. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •19. Понятие функции состояния. Закон Гесса.
- •20. Следствия из закона Гесса. Вычисление тепловых эффектов химических реакций. Следствия из закона Гесса
- •1) Тепловой эффект образования химического соединения равен тепловому эффекту разложения со знаком (-)
- •21. Химическая термодинамика. Предмет и методы. Перечень вопросов на который позволяет ответить химическая термодинамика.
- •22. Термодинамика агрегатных (фазовых) превращений. Процессы фазовых превращений.
- •23. Уравнение Клапейрона — Клаузиуса
- •24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
- •25. Фазовое равновесие: жидкость — пар.
- •26.Фазовое равновесие: твердое тело — пар.
- •27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы.
- •28. Адсорбция. Природа адсорбционных сил. Физическая и химическая адсорбция. Определение абсорбции.
- •29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
- •30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
- •31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
- •32. Диффузия. Определение и основные понятия.
29. Потенциальная кривая адсорбированной молекулы. Теплота адсорбции.
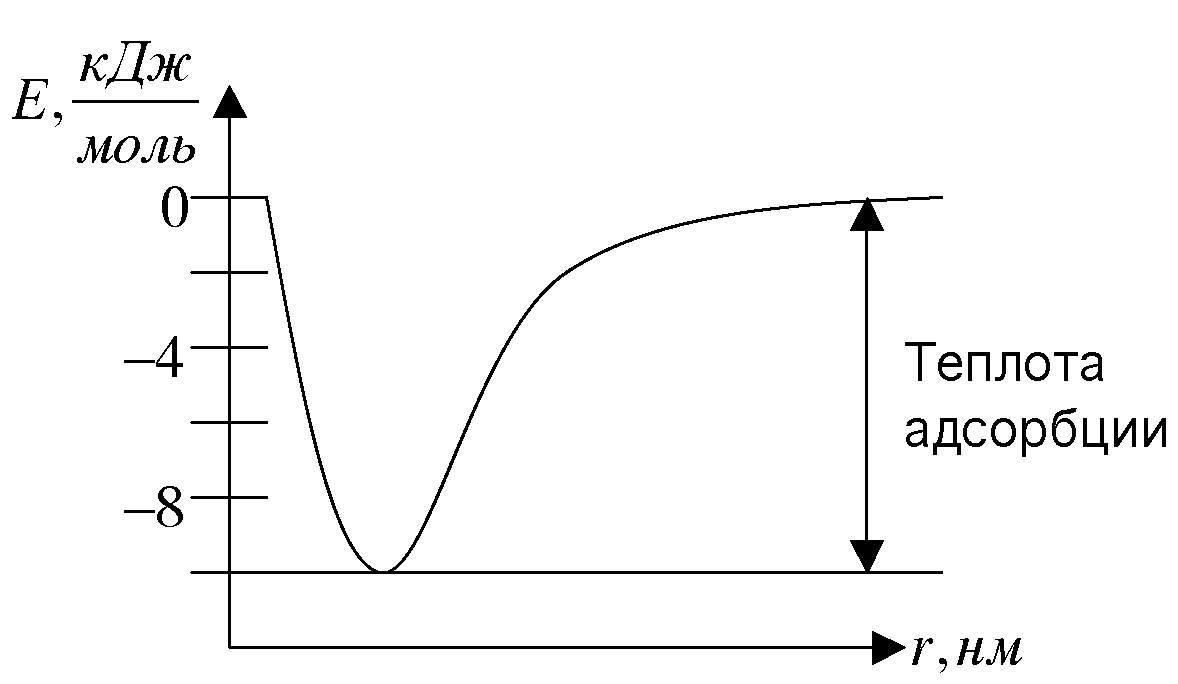
Потенциальная кривая для адсорбции атома аргона на базисной грани графита. При физической адсорбции теплота адсорбции
 моль
моль
При хемосорбции теплота адсорбции близка к тепловому эффекту химических реакций: Еадс = 50...500
30. Адсорбционное равновесие. Время жизни адсорбированной молекулы.
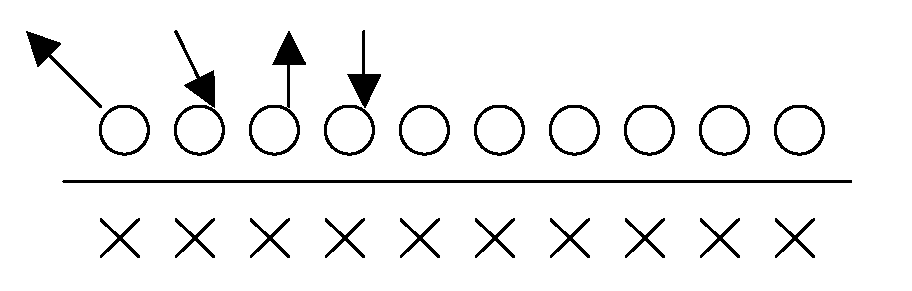
При
некоторой температуре Т
наступает
адсорбционное
равновесие,
когда скорость адсорбции равна скорости
десорбции. Рассмотрим![]() —
время
жизни молекулы
в адсорбированном состоянии. Для аргона
на грани графита
—
время
жизни молекулы
в адсорбированном состоянии. Для аргона
на грани графита
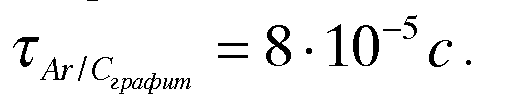 Среднее
время жизни адсорбированной молекулы
сильно зависит от температуры и связано
с теплотой адсорбции:
Среднее
время жизни адсорбированной молекулы
сильно зависит от температуры и связано
с теплотой адсорбции:
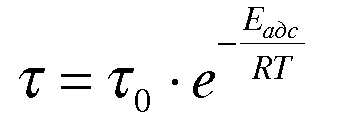
![]() —
период колебаний
адсорбированной молекулы в направлении
поверхности.
—
период колебаний
адсорбированной молекулы в направлении
поверхности.
31. Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
Мономолекулярная адсорбция — адсорбция происходит в один слой. Локализованная адсорбция — если адсорбированные молекулы закреплены на адсорбционных центрах и при этом выделяется максимум энергии.
Модель Ленгмюра: 1) Если молекула попадает на свободный адсорбционный центр, то она остается на нем. 2) Если молекула попадает на занятый адсорбционный центр, то она уходит с поверхности. 3) Адсорбирование имеет место только на определенные адсорбционные центры. 4) Если все адсорбционные центры заняты, то наступает предел адсорбции.
![]() -
число адсорбционных центров на единицу
поверхности.
-
число адсорбционных центров на единицу
поверхности.
![]() -
число занятых адсорбционных центров
на единицу поверхности.
-
число занятых адсорбционных центров
на единицу поверхности.
![]() -
число доступных для адсорбции адсорбционных
центров на единицу поверхности.
-
число доступных для адсорбции адсорбционных
центров на единицу поверхности.
Вероятность
того,
что молекула, ударяющаяся о поверхность
будет адсорбирована равна:
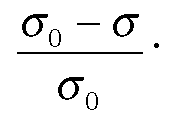 Из
кинетической теории газов. Число
адсорбированных молекул в единицу
времени:
Из
кинетической теории газов. Число
адсорбированных молекул в единицу
времени:
 Если
это выражение помножить на время жизни
одной адсорбированной молекулы, то
получим выражение, которое показывает
число молекул, находящихся в
Если
это выражение помножить на время жизни
одной адсорбированной молекулы, то
получим выражение, которое показывает
число молекул, находящихся в
![]() поверхности:
поверхности:
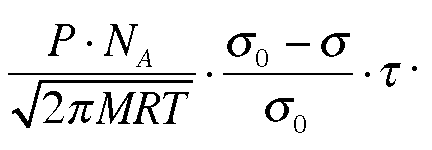 Степень
заполняемости поверхности:
Степень
заполняемости поверхности:
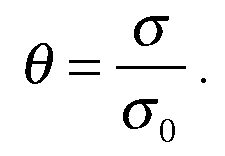 И
введем
обозначение:
И
введем
обозначение:
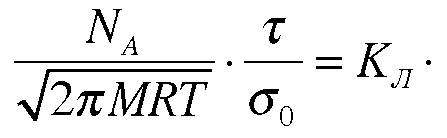
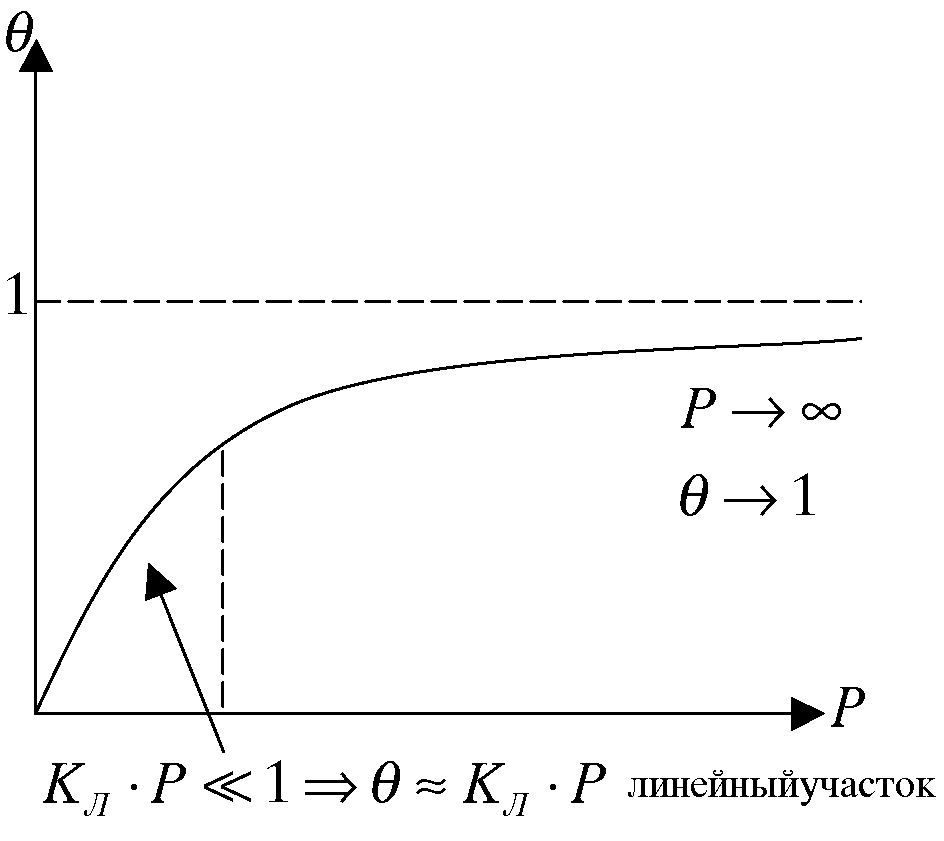
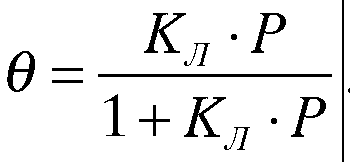
Данное выражение показывает зависимость адсорбции от давления при постоянной температуре и носит название изотермы адсорбции Ленгмюра.
Полимолекулярная адсорбция. Полимолекулярная адсорбция характерна для адсорбции газов, в случае, если газы не реагируют с поверхностью и не разлагаются на ней.
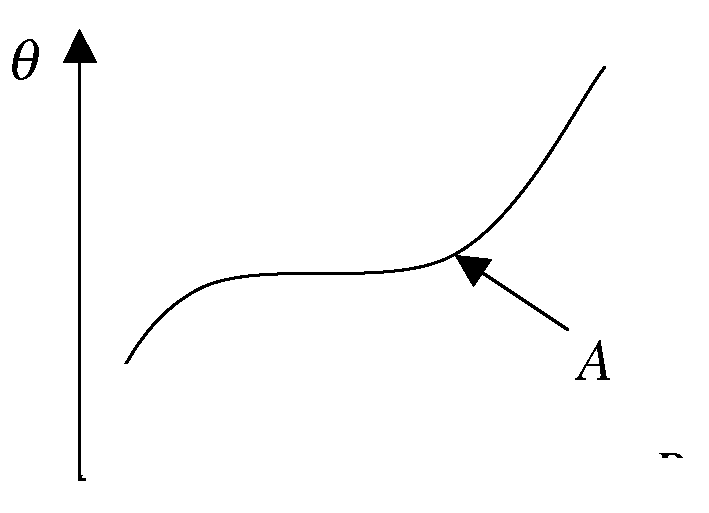
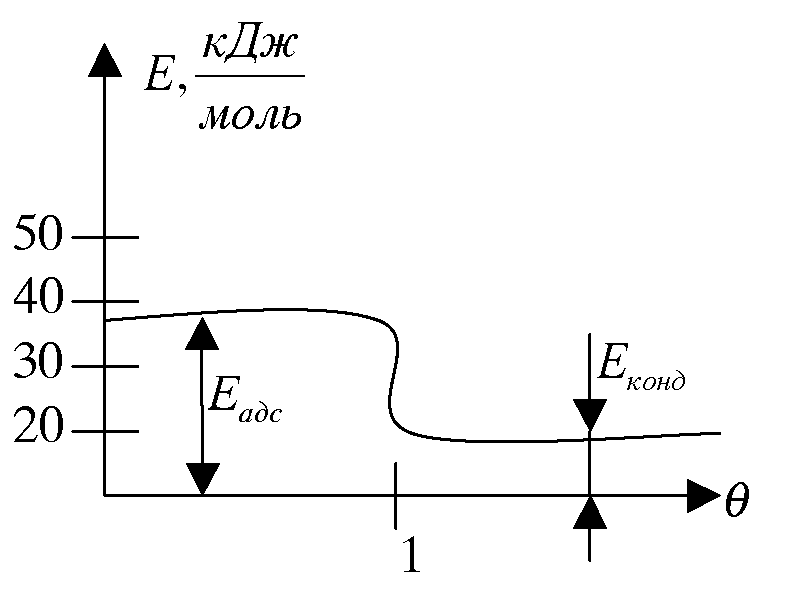
Теплота адсорбции 2 слоя атомов или молекул очень мала. Изотермы паров при Т < Ткип часто имеют S -образную форму. В точке A внешнее давление приближается к давлению насыщенных паров и происходит объемная конденсация паров. Такая адсорбция называется /Т <Т/ полимолекулярной. Для того, чтобы имела место полимолекулярная адсорбция, необходимо, чтобы время жизни молекул второго слоя было соизмеримо со временем изни молекул первого слоя. В противном случае ( Т2 <ТХ) наблюдается ономолекулярная адсорбция. Взаимодействие между (1 и 2), (2 и 3) и т.д. слоями определяется энергией конденсации. При адсорбции пара молекулы, попадая на уже занятую поверхность, образуют адсорбционные комплексы второго слоя. Между молекулами одного слоя и молекулами следующего слоя существует взаимодействие и оно постоянно для молекул этих двух слоев. Молекулы любого отдельно взятого слоя не взаимодействуют друг с другом. Начиная со второго слоя адсорбция и десорбция протекают так же как в жидкостях и теплота адсорбции равна теплоте конденсации.
Уравнение изотермы Брунауэра-Эммета-Теллера
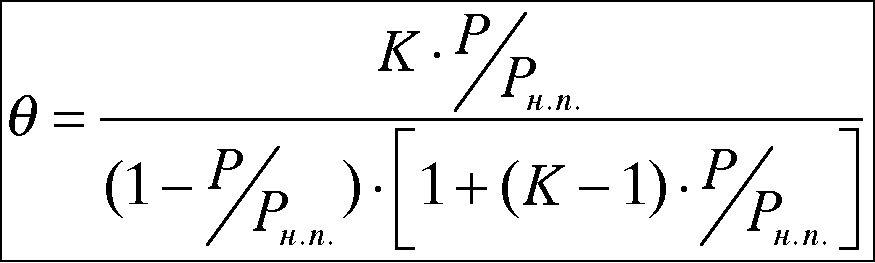
![]() -
текущее давление.
-
текущее давление.
![]() -
давление насыщенных паров. Если
-
давление насыщенных паров. Если
![]() , то уравнение БЭТ упрощается:
, то уравнение БЭТ упрощается:
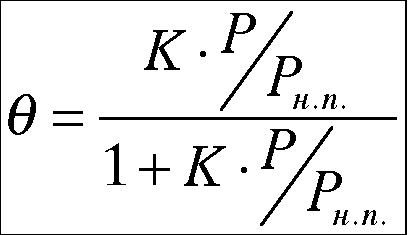 Принимая
Принимая
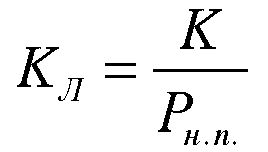 при данных условиях БЭТ вырождается в
уравнение адсорбции Ленгмюра. Таким
образом уравнение адсорбции Ленгмюра
описывает адсорбцию при давлениях пара
гораздо меньших, чем давление насыщенного
пара.
при данных условиях БЭТ вырождается в
уравнение адсорбции Ленгмюра. Таким
образом уравнение адсорбции Ленгмюра
описывает адсорбцию при давлениях пара
гораздо меньших, чем давление насыщенного
пара.
