- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Лекція №4. Твердий стан речовини
Основні питання:
Твердий стан речовини.
Кристалічні та аморфні речовини.
Сублімація, її значення в консервуванні харчових продуктів.
Утворення та руйнування кристалів. Використання закономірностей цих процесів при виборі режимів заморожування і розморожування харчових продуктів.
Твердий стан речовин – найвищий ступінь організації речовини, як і рідкий, називають конденсованим.
Характеризується значними силами взаємодії між частинками: частинки не переміщуються, а тільки коливаються біля певних середніх положень рівноваги.

Кристалами називаються тверді, однорідні, анізотропні тіла, здатні нарощувати грані за рахунок відкладання нових частинок та викликати дифракцію рентгенівських променів.
Полікристали – це агрегати значної кількості дрібних, по-різному орієнтованих монокристалів неправильної форми, регулярні ділянки структури яких існують у певних межах.
Однорідність (ізотропність) кристалів виявляється в тому, що вони в усіх своїх частинах у паралельних напрямках мають однакові властивості.
Анізотропність (векторіальність) – це неоднаковість фізичних властивостей кристалів у непаралельних напрямках. Зумовлена внутрішньою будовою кристалів – різною відстанню між частинками в різних напрямках.
|
|
|
|
Кристал вітерита |
Кристал |
Форми кристалів |
Структура кристалу магнію Структура кристалу NaCI |
|
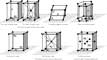
Елементарні комірки 14 типів просторових граток |
|
|
Кристалічна ґратка – це математична абстракція, що визначає відносне розміщення вузлів у просторі.
Просторова ґратка є геометричним образом кристалічної ґратки – каркасу вузлів, що регулярно повторюються й паралельно розміщуються у просторі, в яких можуть міститися частинки речовини.
Найменшу частинку кристала з характерною для даного типу ґратки структурою називають елементарною коміркою.
Елементарна комірка – це паралелепіпед, трансляцією якого в напрямку кожної з трьох координатних осей можна побудувати всю кристалічну ґратку.
Структура – це реальне розташування матеріальних частинок у кристалі. Одній й тій же ґратці може відповідати декілька різних структур.
Структурний тип характеризує відносне розміщення частинок у просторі без урахування відстаней між ними. Число різних типів ґраток дорівнює 14, а число різних структурних типів нескінченно велике.
Кристалічна структура твердої речовини визначається трьома факторами (Гольдшмідт, 1926):ё
хімічним складом речовини;
розмірами структурних складових;
природою сил, що утримують ці складові в кристалі.
Енергія кристалічної решітки (Екр) – це енергія, яку необхідно прикласти для руйнування кристалічної ґратки і відокремлення її складових частин на таку відстань, на якій вже не відбувається їх взаємодія. Одиниці вимірювання – кДж/моль.
Кількісно характеризує міцність кристалу: Екр(NaCІ) = 771кДж; Екр (КІ) = 687кДж
Висновок: кристали NaCL більш міцні, ніж КІ.