- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Каталіз
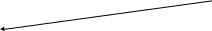
(каталізатор
і реагуюча система – в однаковому
фазовому стані)
У
газовій фазі: 2N2O(г)
→ 2N2(г)
+ О2(г) каталізатор
– СІ2(г)
У
водній фазі: СН3СООС2Н5(р)
+ Н2О(р)
→ СН3СООН(р)
+ С2Н5ОН(р) каталізатор
– кислота (р) (каталізатор
і реагуюча система знаходяться в різних
фазових станах).
Всі
гетерогенні процеси відбуваються на
поверхні
фазового розділу.
У
газовій фазі: N2(г)
+ 3Н2(г)
↔ 2NH3(г) каталізатор
– суміш заліза та ванадію (тв.)
У
рідкій фазі: С8Н10(р)
→ С4Н10(г)
+
С4Н8(г) Каталізатор:
суміш AL2O3
ї SiO2(тв).
Здійснюється на
поверхні каталізатора (подрібненого
для збільшення поверхні стикання). (в
біологічних системах за участю
біокаталізаторів, тобто ферментів).
Ферменти
– каталізатори білкової природи, які
утворюються і функціонують в усіх живих
організмах.
В організмі людини
близько 30тис. ферментів. Особливості
ферментів: висока
специфічність; висока
каталітична дія; висока
молекулярна маса; білкова
природа; наявність
лише в живих організмах. Не
входять до складу продуктів реакції. Не
зсувають положення рівноваги, а
прискорюють його досягнення. Не
викликають реакції, що суперечать
законам термодинаміки.Гомогенний
Гетерогенний
Ферментативний
Загальні властивості:

Теорія проміжних сполук для пояснення гомогенного каталізу Арреніус, 1889р. – дія каталізатора полягає в утворенні проміжної сполуки (інтермедіата). Каталізатор (К) вступає в реакцію з реагентом – субстратом (S), в результаті – проміжна сполука (КS), яка розкладається з утворенням продукту (П) і каталізатора (К): І стадія: К + S → КS (інтермедіат) ІІ стадія: KS → К + П Каталізатор витрачається на І стадії й регенерується на ІІ стадії. Для реакції з двома реагентами: І стадія: А + К → АК (інтермедіат) ІІ стадія: АК + В → П + К Сумарна реакція: А + В → П Неорганічний каталізатор у ході реакції не витрачається. |
Ферментативний каталіз Фермент знижує бар’єр активації реакції, яку він каталізує, поділяючи її на ряд проміжних етапів: І етап. Субстрат з’єднується з ферментом за рахунок слабких сил. ІІ етап. Відбувається активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів, супроводжується розривом і утворенням ковалентних зв’язків. ІІІ етап. Відокремлення продуктів реакції від ферменту, який змінює молекулу субстрату так, що міцність окремих хімічних зв’язків зменшується, що призводить до зниження енергії активації.
|
Адсорбційна теорія гетерогенного каталізу Включає фізичну адсорбцію та хемосорбцію. Стадії каталізу: І стадія: Дифузія (молекули реагентів дифундують до поверхні твердої речовини); ІІ стадія: Адсорбція (реагуючі молекули зв’язуються міжмолекулярними силами Ван-дер-Ваальса з „активними центрами на поверхні каталізатора, потім хімічними зв’язками); ІІІ стадія: відбувається хімічна реакція з утворенням продуктів; ІV стадія: Десорбція (молекули продуктів зв’язуються хімічними зв’язками з „активними центрами”, потім міжмолекулярними зв’язками, потім вивільняються з поверхні каталізатора); V стадія: Дифузія (молекули продуктів дифундують від поверхні каталізатора). |
Загальна схема ферментативного каталізу: Е + S → ЕS → ЕS*→Е+П, де Е – фермент; S – субстрат; ЕS – первинний фермент – субстратний комплекс; ЕS* ‑ активований комплекс; П – продукт реакції Висновок: Каталітична дія ферментів реалізується за рахунок зниження енергії активації біохімічної реакції. У ході реакції фермент поступово інактивується – втрачає свою активність і руйнується. |
|