- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
Основні питання:
Агрегатні стани речовини, їх загальна характеристика.
Ідеальний газ, основні закони ідеального газу.
Реальні гази. Рівняння Ван-дер-Ваальса.
Зрідження газів. Застосування зріджених газів.
Залежно від зовнішніх умов речовина може перебувати в трьох основних станах: твердому, рідкому, газоподібному. Можливі інші стани: рідкокристалічний, плазмовий, нейтронний, гіперонний тощо. Кожний агрегатний стан відрізняється від іншого характером руху частинок і типом взаємодії між ними. Стабільність агрегатного стану пов’язана зі співвідношенням кінетичної (Ек) та потенціальної (Ер) енергії взаємодіючих частинок.
Характеристика агрегатних станів речовини
Агрегатний стан речовини |
Співвідношення Ек і Ер частинок |
Об’єм |
Форма |
Стисливість |
Густина |
Газоподібний |
Ек > Ер |
Співпадає з об’ємом посудини, залежить від температури і тиску |
Заповнює посудину, приймаючи його форму |
Висока |
Низька |
Рідкий |
Ек = Ер |
Фіксований |
Нефіксована - повністю або частково заповнюють посудину |
Незначна |
Від помірної до великої |
Твердий |
Ек < Ер |
Фіксований |
Фіксована |
Практично відсутня |
Значна |
Характерна особливість газоподібного стану – вільний рух частинок (атомів, молекул) в об’ємі, що значно перевищує об’єм самих частинок.
Сили міжмолекулярної взаємодії виявляються, коли молекули наближаються одна до одної на достатньо близьку відстань.
Це зумовлює:
невелику густину газів;
здатність до безмежного розширення;
створення тиску на стінки посудини, що чинить опір;
істотні відмінності властивостей при високих тисках і низьких температурах.
Термін „газ” запроваджений датським вченим Дж.Ван Гельмонтом (1577 – 1644), означає „хаос” (від грецького слова).
Ідеальний газ – це газ, що знаходиться в такому стані, де можна нехтувати силами міжмолекулярної взаємодії та об’ємом молекул цього газу. Це спрощена модель реального газу.
Газові закони – математичні співвідношення між температурою, тиском та об’ємом газів (цілком точні для ідеального газу, а для реального – тільки при дуже малих тисках). Фізичний стан ідеального газу визначається трьома параметрами: Т, Р, V, які зв’язані між собою в рівняння стану ідеального газу.
Кінетична теорія газів – математична модель ідеального газу, яка дає змогу визначити поведінку газів і закони газового стану.
Виходячи з кінетичних уявлень про будову матерії, М.В.Ломоносов (1749р.) доповнив положення кінетичної теорії газів.
Основні положення кінетичної теорії газів
Газ складається з частинок дуже мізерного об’єму (об’ємом частинок можна нехтувати), які не взаємодіють між собою (крім зіткнень). Потенціальна енергія частинок ідеального газу дорівнює нулю та траєкторія їх руху ‑ лінійна.
Частинки газу безперервно та хаотично рухаються (Р,Т – зумовлені рухом частинок). Середня швидкість їх поступового руху при Т= const постійна, і вони рівномірно заповнюють наданий об’єм.
Між частинками газу відсутні сили притягання.
Частинки газу – ідеально пружні, тому їх зіткнення не супроводжуються втратою кінетичної енергії.
Т – статистичний сумарний ефект руху всіх частинок газу; Р – результат зіткнень частинок газу зі стінками посудини;
Т↑, υ↑, А↑ (частота зіткнень), Р↑.
Середня кінетична енергія частинок газу пропорційна його абсолютній температурі (Т↑, Ек↑, υ↑).
Еповна = U + (Ек + Ер) системи

(Ек + Ер)частинок
Ер – потенціальна енергія, зумовлена силами притягання (відштовхування) між частинками.
Ек – кінетична енергія (енергія поступального, коливального обертального руху частинок)
При зіткненнях енергія окремих частинок змінюється, проте сумарна енергія всіх частинок залишається постійною.
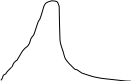
% молекул
Т2 Т1
0 V |
Статистичний закон розподілу Максвелла-Больцмана (1871). Криві розподілу молекул газу за швидкостями для двох температур: Т1<Т2 – графічний вираз закону. Максимум зміщується з підвищенням температури в бік більших швидкостей (найбільш імовірна швидкість).
|
|||
Рівняння кінетичної теорії газів |
||||
Рівняння |
Математичний вигляд |
Пояснення |
Примітка |
|
Основне рівняння кінетичної теорії газів (Клаузіус, 1857) |
рV
=
|
m – маса частинки; N – число частинок; р – тиск газу; V ‑ об’єм газу; υ2 – квадрат середнього значення швидкості. |
Дозволяє обґрунтувати газові закони, встановити зв'язок між мікроскопічними та макроскопічними властивостями ідеального газу. Обчислити швидкість і кінетичну енергію частинок газу. |
|
Рівняння середньоквадратичної швидкості частинок газу (υср-кв
=
|
υср-кв
=
|
Т – абсолютна температура; μ – молярна маса газу; R – універсальна газова стала 8,31Дж/моль∙К; υср=кв – середньоквадратична швидкість. |
З підвищенням температури зростає швидкість руху молекул; За однакової температури швидше рухаються молекули з меншою масою. |
|
Рівняння кінетичної енергії частинок газу |
Ек
=
|
Ек – кінетична енергія; Т – абсолютна температура; R – універсальна газова стала. |
З підвищенням температури зростає кінетична енергія частинок. |
|

 Т2>
Т1
Т2>
Т1