
- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Лекція №6. Термохімія: основні поняття та закони
Основні питання:
Термохімія. Термохімічні рівняння.
Теплоти (стандартні молярні ентальпії) утворення, розкладу, згорання, розчинення.
Основні закони термохімії: закон Лавуазьє-Лапласа, закон Гесса.
Термохімія ‑ область хімії, яка займається дослідженням змін ентальпії при перебігу хімічних реакцій і фазових перетвореннях.
Експериментальна методика, що застосовується для визначення ентальпії, називається калориметрія.
Зміни ентальпії під час перебігу хімічної реакції
Екзотермічна реакція ∆Н<0, Н2 < Н1 (ентальпія продуктів менша ентальпії реагентів), теплота виділяється. Q = - ∆Н
Н Реагенти
∆Н<0 (ентальпія зменшується)
Продукти
Енергія, що втрачається в ході реакції, надходить в реакційну суміш, підвищуючи її температуру. Ця енергія передається оточенню, в кінці реакції температура реакційної суміші знижується. |
|
Ендотермічна реакція ∆Н>0, Н2>Н1 (ентальпія продуктів більша ентальпії реагентів), теплота поглинається системою. Q = ∆Н
Н Продукти
∆Н>0 (ентальпія зростає)
Н 1 Реагенти
Енергія, що поглинається в ході реакції, відбирається з реакційної суміші, внаслідок цього відбувається зниження її температури. Теплова енергія передається від оточення у суміш, в кінці реакції температура реакційної суміші знову підвищується. |
Тепловий ефект реакції (∆Н0) – кількість енергії, що вивільняється або поглинається системою в процесі необоротної хімічної реакції (за умов Р = const, Т = const). Одиниці вимірювання – Дж (кДж) до 1 моля речовини.
Запис хімічних рівнянь реакцій із вказанням теплових ефектів називають термохімічними рівняннями.
½ СІ2 (г) + ½ Н2(г) → НСІ(г), ∆Н0 = ‑ 93кДж
Для запису термохімічних рівнянь:
використовують дробові коефіцієнти;
вказують агрегатні стани реагентів і продуктів: m – (твердий); р – (рідкий), г – (газуватий).
вказують тепловий ефект (ентальпію реакції).
Для порівняння теплових ефектів різних процесів їх відносять до одного моля речовини за стандартних умов:
Т = 298К (250С), Р = 1,01∙105Па (1 атм.).
Основні поняття термохімії
Визначення |
Позначення, одиниці вимірювання |
Рівняння |
Теплота утворення (стандартна молярна ентальпія утворення) – кількість теплоти, що виділяється або поглинається при утворенні 1 моль складної речовини зі стабільних форм простих речовин за стандартних умов. |
∆Н0утв.(Н2О) = ‑ 285,9кДж/моль ∆Н0утв. (простих речовин) = 0 ΔН0298 |
Н2 (г) + ½О2 (г) → Н2О (р), ∆Н0 = ‑ 285,9кДж, екзотермічна реакція |
Теплота розкладу (стандартна молярна ентальпія розкладу) – кількість теплоти, що вивільняється або поглинається при розкладанні 1 моль складної речовини на прості речовини за стандартних умов. |
∆Н0розкл.(Н2О) = + 285,9кДж/моль ∆Н0утвв. = ‑ ∆Н0розкл. |
Н2О(р) → Н2(2) + ½О2(г) ∆Н0 = + 285,9кДж, ендотермічна реакція |
Примітка. • ∆Н0утв. твердих сполук мають більші (за абсолютною величиною) негативні значення, ніж ∆Н0утв. газів. • Чим більше негативне значення (за абсолютною величиною) ∆Н0утв. сполуки, тим більша стійкість даної речовини. |
||
Основні поняття термохімії
Визначення |
Позначення, одиниці вимірювання |
Рівняння |
Теплота згорання (стандартна молярна ентальпія згорання) – кількість теплоти, що вивільняється при спалюванні 1 моль речовини в потоці кисню за стандартних умов. |
∆Н0згор.(С3Н6) = ‑ 219,7кДж/моль |
С3Н6
(г) + 4 ∆Н0 = ‑ 2219,7кДж, екзотермічна реакція |
Примітка. Теплота згорання харчових продуктів в живому організмі є джерелом енергії за рахунок якої здійснюється його життєдіяльність. До макрокомпонентів їжі належать: білки, жири, вуглеводи, етанол (в алкогольних напоях). |
||


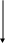 Н1
Н1 Н2
Н2
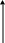 Н2
Н2