- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
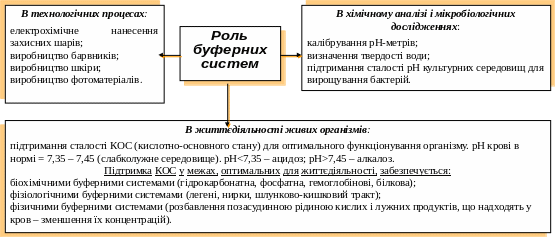
Буферні розчини
(здатні зберігати значення рН при розведенні або при додаванні невеликих кількостей кислоти чи лугу)
Розчини, що містять слабку кислоту і сіль цієї кислоти з сильною основою (рН=4-7) |
Розчини, що містять слабку основу і сіль цієї основи з сильною кислотою (рН=7-10) |
Розчини, що містять солі багатоосновних слабких кислот рН=7,35-7,45 |
||
СН3СООNa → СН3СОО- + Na+ NaНСО3 → Na+ + НСО3- (дисоціація солей) Часткова дисоціація слабких кислот: СН3СООН +Н2О ↔ СН3СОО- + Н3О+ Н2СО3 + Н2О↔НСО3- + Н3О+
рівновага зміщується ліворуч, відновлюється рН. СН3СОО- + Н+↔СН3СООН
Н3О+ + НСО3-→Н2СО3 + Н2О (Надлишкова концентрація Н+ нейтралізується взаємодією з НСО3-). Надлишок Н2СО3 гідролізується у присутності ферменту карбоангідрази: Н2СО3↔ СО2 + Н2О СО2 вилучається через легені. |
NH4Cl→ NH4+ + Cl- (повна дисоціація солі). NH4OH ↔ NH4+ + ОН- (часткова дисоціація).
Н3О+ + NН3Н2О → 2Н2О + NН4+ (нейтралізація кислоти іонами ОН-, [ОН -]=const, рН=const
рівновага при дисоціації аміаку зміщується ліворуч, [ОН-]=const NH4+ + ОН-↔ NH4OH (ОН- зв’язуються з іонами NH4+, утвореними в результаті дисоціації солі, рН=const). |
Na2HPO4↔ 2Na+ + HPO4- NaH2PO4↔ Na+ + H2PO4- Між гідрофосфат- і дигідрофосфат-іонами встано-влюється рівновага: НРО42- + Н3О+ ↔Н2РО4- + Н2О НРО42- + Н2О ↔Н2РО4- + ОН-
НРО42- (аніон дуже слабкої кислоти, акцептор іонів Н3О+) зв’язує іони водню сильної кислоти з утворенням Н2РО4- НРО42- + Н3О+ →Н2РО4- + Н2О
Н2РО4- + ОН-→ НРО42- + Н2О |
||
Н3О+ + ОН- → 2Н2О Нейтралізація іонами Н3О+ гідроксид-іонів, рівновага в реакції дисоціації кислоти зміщується праворуч, рН-const СН3СООН + NaОН → СН3СООNa + Н2О. При надходженні лужних продуктів – кисла частина буферної системи нейтралізує луг: Н2СО3 + ОН-→НСО3- + Н2О НСО3- ‑ виводиться нирками. Висновки:
рН=рКа
+ lg |
Висновки:
рН=14
– рКв
+ lg |
Висновки:
НРО42- зв’язують іони Н+ (рівновага зміщується праворуч, утворюються Н2РО4-);
Н2РО4- зв’язують іони ОН- (рівновага зміщується ліворуч, утворюються НРО42-). рН
= рКн2ро4-
‑ lg
|
|
|
Таким чином, рН буферного розчину певного складу визначається відношенням концентрації кислоти і солі або основи і солі (не залежить від розведення).
При зміні об’єму розчину концентрація кожного компоненту змінюється в однакове число раз і їх співвідношення залишається сталим.
Буферна суміш підтримує сталим значення рН за умови: кількість доданих до розчину кислоти або основи не перевищує граничної величини (буферна ємність).
Здатність буферних розчинів протидіяти зміні рН – буферна дія.
Межі, в яких проявляється буферна дія, називається буферна ємність (кількість моль еквівалентів сильної кислоти або сильної основи, що треба додати до 1л буферного розчину для зміни рН середовища на одиницю).
Буферна ємність залежить від:
природи і концентрації компонентів буферного розчину;
співвідношення концентрацій компонентів.
Чим більша концентрація компонентів, чим ближче співвідношення концентрацій: кислота – сіль, основа – сіль до одиниці, тим більша буферна ємність.