- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
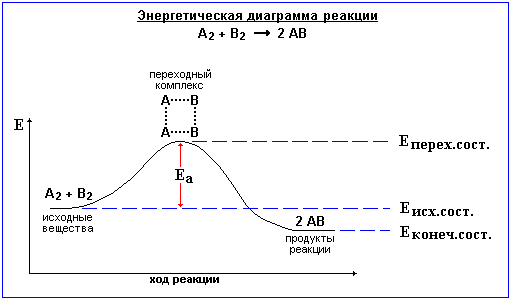
Теорія перехідного стану
Теорія перехідного стану: кожна хімічна реакція відбувається через утворення активованого комплексу, який потім розпадається на продукти даної реакції. Більшість хімічних реакцій відбувається через перехідний стан (енергетично вигідно).
Реакційноздатна система:
Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
Активований комплекс – система, що утворена активними молекулами, де одночасно відбувається розрив старих хімічних зв’язків і утворення нових.
На утворення комплексу витрачається енергія активації, яка становить різницю між енергією активованого комплексу та середньою енергією вихідних речовин.
Активований комплекс за дуже короткий час (порядку 10-13с) самочинно розпадається на продукти реакції.
|
АК – max потенціальної енергії. Рівень енергії І відповідає середній енергії реагентів. Рівень енергії ІІ відповідає середній енергії продуктів. Під час хімічного процесу перехід системи реагентів з енергетичним станом Ереаг у енергетичний стан продуктів реакції Епр здійснюється через енергетичний бар’єр, який дорівнює енергії активації системи Еа. Подолання енергетичного бар’єру затримує або робить неможливим багато реакцій, які термодинамічно можуть відбуватися самочинно. Еа залежить від природи реагуючих речовин ∆Н = Еапрод ‑ Еареаг |
Перебіг реакції може відбуватися трьома різними шляхами:
Дисоціативним (молекули взаємодіють через стадію дисоціації);
Радикально-ланцюговим (взаємодіють вільні радикали, утворені під дією зовнішньої енергії);
Молекулярним (взаємодія молекул проходить через стадії утворення та розпаду активованого комплексу.
Сумарний енергетичний баланс реакції не відображає її механізму. В усіх трьох випадках він буде однаковим, оскільки не залежить від шляху здійснення процесу (закон Гесса).
Перебіг реакції, її механізм можна визначити за її енергією активації.
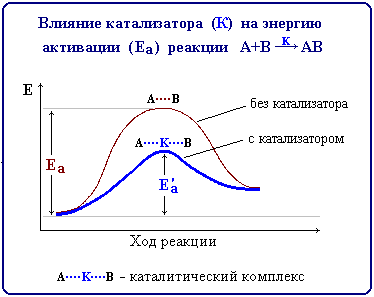
Вплив каталізатора на швидкість реакції
Каталізатор – це речовина, що прискорює швидкість реакції, бере участь у її проміжних стадіях, але кількісно і якісно при цьому не змінюється.
Основна роль каталізатора – утворення з реагентом проміжних реакційно здатних сполук, які легко розкладаються на продукти реакції.
Особливості каталізаторів:
Кількість каталізатора дуже мала (в реакції: 2Na2SO3 + O2 → 2Na2SO4 концентрація Cu2+ складає 10-13моль/л);
Специфічність дії, тобто для кожної реакції існує свій каталізатор;
Застосовуючи різні каталізатори, можна з тих самих вихідних речовин одержувати різні продукти:
С2Н5ОН → СН3 – СОН + Н2, каталізатор – Cu, Ni;
С2Н5ОН → С2Н4 + Н2О, каталізатор – Al2O3.
Каталізатор не впливає на загальну стехіометрію реакції;
Каталізатор однаково прискорює пряму та зворотну реакції, дозволяє швидше досягти стану хімічної рівноваги, але не змінює положення рівноваги;
|
|
Кінетика процесів випікання і висушування харчових продуктів у виробництві харчової продукції
Кінетика процесу випікання хлібобулочних виробів. Основним рухомим фактором процесу випікання є прогрівання тіста – вологого колоїдного капілярно-пористого матеріалу. Механізм випікання обумовлений характером переносу теплоти і вологи в середину матеріалу (хліба). Переміщення вологи обумовлене наявністю градієнта потенціалу переносу.
При прогріванні борошняних виробів у кондитерських пекарських печах (променистий і конвекційний теплообмін) спочатку відбувається рух вологи в матеріалі у напрямі теплового потоку: в середину зразка (явище тепловологопереносу), а потім інтенсивне випаровуванні вологи при переміщенні поверхні (зони) випаровування у глибину матеріалу.
Процес випікання складається з двох періодів:
Період змінного (зростаючого) об’єму і зростаючої швидкості вологовіддачі. У поверхневому шарі зразка створюється значний температурний градієнт. Утворення скоринки відбувається в основному за рахунок термовологопровідності. При цьому потік вологи, спрямований у глибину зразка, переносить деяку кількість теплоти. Одночасно відбуваються колоїдно-хімічні процеси ендотермічного характеру, в результаті яких волога в м’якушці тіста зв’язується крохмалем, що клейстеризується.
Період постійного об’єму і постійної швидкості вологовіддачі (при постійному режимі пекарної камери). Утворення скоринки відбувається шляхом поглиблення зони випаровування, вологість м’якушки практично не змінюється, а випаровування відбувається в основному в зоні на межі скоринки і м’якушки, волога переміщується у вигляді пари (випаровування вологи відбувається в скоринці, з якої частина міцної адсорбційно-зв’язаної вологи видаляється після руху зони випаровування всередину). Наприкінці процесу випікання об’єм хліба може зменшуватися за рахунок усадки поверхневих (зневоднених) шарів.
Вода у харчових продуктах відіграє важливу роль, так як обумовлює консистенцію і структуру продукту, її взаємодія з присутніми компонентами визначає стійкість продукту при зберіганні.
Загальна вологість продукту вказує на кількість вологи в ньому, але не характеризує її приналежність до хімічних, біохімічних і мікробіологічних змін в продуктах. Для забезпечення стійкості продукту при його зберіганні відіграє співвідношення вільної та зв’язаної вологи.
Зв’язана волога – це асоційована вода, міцно зв’язана з різними компонентами – білками, ліпідами та вуглеводами за рахунок хімічних і фізичних зв’язків.
Вільна волога – це волога, не зв’язана з полімером і доступна для перебігу біохімічних і мікробіологічних реакцій.
При вологості зерна 15-20% зв’язана вода складає 10-5%. При більшій вологості з’являється вільна волога, що сприяє збільшенню біохімічних процесів (пророщування зерна).
Плоди та овочі мають вологість 75-95%. В основному, це вільна вода, однак приблизно 5% вологи утримується клітинними колоїдами в міцно зв’язаному стані. Тому овочі та плоди легко висушити до 10-12%, проте висушування до більш низької вологості потребує застосування спеціальних методів.
Зв’язана волога:
характеризує рівноважний вологовміст зразка при деякій температурі та низькій відносній вологості;
не замерзає при низьких температурах (-400С і нижче);
не може служити розчинником для добавлених речовин;
утворює смугу в спектрах протонного магнітного резонансу;
переміщується разом з макромолекулами при визначенні швидкості седиментації, в’язкості, дифузії;
існує поблизу розчиненої речовини та других неводних речовин і має властивості, що значно відрізняються від властивостей всієї маси води в системі.
Види фізико-хімічних зв'язків вологи з матеріалом:
адсорбційно зв’язана вода (утримується на внутрішній поверхні капілярів і пор продуктів);
осмотично зв’язана вода (утримується за рахунок сил осмотичного тиску;
структурно зв’язана вода (утримується всередині клітин рослинного і тваринного походження);
хімічно зв’язана вода (молекулярний зв’язок молекул речовини з молекулами води). не можна видалити висушуванням. Використовують прожарювання продукту або дію спеціальних хімічних речовин.
Сушіння – тепловий процес, що забезпечує зневоднення різних продуктів.
Процес висушування відбувається за рахунок підведення теплоти до продукту, що висушується. Внаслідок висушування відбувається випаровування вологи. У виробництві харчової продукції висушуванню підлягають тверді, пастоподібні та рідкі продукти (м'ясо, хліб, яйця, бульйони, молоко). Висушування сировини проводять з метою одержання нового продукту, що має більшу область використання, наприклад, виробництво сухого молока і різних молочно-рослинних продуктів.
Рівноважна вологість матеріалу – одна з характеристик процесу висушування.
Якщо вологий продукт помістити в ізольовану посудину з вологим повітрям, то в результаті взаємодії продукту з водою:
частина вологи з продукту перейде у повітря;
продукт поглине частину вологи з повітря.
Після такої взаємодії встановиться рівновага між продуктом і повітрям. Рівноважна вологість залежить від парціального тиску водяної пари при заданій температурі.
Отже, залежно від параметрів повітря, що використовується як сушильний агент, продукт можна висушити тільки до рівноважної вологості, яка визначається відносною вологістю повітря.
![]() (Н2О)
=
(Н2О)
=
![]() ,
,
де (Н2О) – масова частка води (вологість), %;
m(H2O) – маса видаленої вологи, кг;
m0 – маса продукту, кг.
Кінетика процесу висушування. При висушуванні волога переміщується від центра до периферії (дифузійний процес), рухомою силою є різниця концентрації вологи.
Кількість мігруючої вологи під дією різниці її концентрацій можна обчислити за формулою:
![]()
де Кв – коефіцієнт волого провідності, м2/с;
![]() ‑
градієнт
концентрації вологи в продукті, кг/м4;
‑
градієнт
концентрації вологи в продукті, кг/м4;
S – поверхня контакту продукту з джерелом теплоти, м2;
τ – тривалість процесу, с.
Міграція вологи у глибину продукту відбувається також під дією температурного градієнта. Рівняння згідно з яким можна визначити кількість вологи, що переміщується за рахунок температурного градієнта, має вигляд:
![]() ,
,
де Кt ‑ коефіцієнт термовологопровідності, кг/(м·К);
![]() ‑ градієнт
температур, К/м.
‑ градієнт
температур, К/м.
При цьому волога під дією тепла переміщується у напрямі теплового потоку. Отже, при нагріванні продукту волога з поверхні під дією температурного градієнта переміщується від периферії до центру. Для зменшення ефекту термовологопровідності, продукт при висушування необхідно подрібнити.
Сумарна маса вологи, що переміщується при наявності різниці її концентрацій і температурного градієнта визначається за формулою:
Wзаг = Wв – Wt,
де Wзаг ‑ загальна кількість дифундуючої вологи.
Процес висушування складається з трьох етапів:
Переміщення вологи усередині продукту у напрямі до його поверхні.
Пароутворення.
Переміщення пари від поверхні матеріалу до навколишнього середовища.
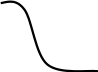
Наочно представити кінетику процесу висушування і швидкість процесу висушування можна за допомогою кривих висушування та швидкості висушування. Для побудови кривих використовують експериментальні та аналітичні дані.
Виділяють два основні періоди висушування. На початку процесу проводиться підігрівання продукту і вивільняється лише незначна частина вологи.
Wt, %
|
Період постійної швидкості висушування характеризується видаленням вільної вологи; при цьому тиск пари над матеріалом дорівнює тиску пари чистої рідини, що випаровується за тих же умов. Волога, що надходить із внутрішніх шарів, повністю перетворюється на пару і видаляється з поверхні матеріалу. Залежить від зовнішньої дифузії (видалення вологи з поверхні продукту). Ефективність висушування в цей період залежить від кількості теплоти, підведеної до продукту (витрачається на випаровування води і відведення вологи з поверхні). Період висушування наступає при досягненні точки К1, що вказує на критичну вологість. Цей період називається періодом падаючою швидкості висушування. Інтенсивність процесу визначається внутрішньою дифузією зв’язаною в продукті вологи. Закінчується другий період в критичні точці Кр, що відповідає рівноважній вологості матеріалу Wр. У цей період висушування до поверхні продукту надходить менше вологи, ніж могло би випаровуватися. |
Крива висушування |
Форма кривої висушування залежить від:
|
На основі кривих
висушування можна побудувати криві
швидкості висушування, що представляють
собою графік залежності швидкості
висушування
![]() від вмісту вологи в продукті.
від вмісту вологи в продукті.
Вертикальна пряма представляє із себе період прогрівання продукту, а горизонтальна пряма відповідає постійній швидкості висушування. І – період падаючої швидкості. ІІ – період постійної швидкості. ІІІ – прогрівання продукту. Від точки К1, що відображає критичну вологість матеріалу, починається область падаючої швидкості. Точка А означає швидкість висушування, що дорівнює нулю. Вологість продукту при цьому досягає рівноважного значення. |
|
І К1
ІІ ІІІ Wр
0 А Wкр W, % |
Фотохімічні та ланцюгові реакції
Фотохімічні реакції – це хімічні реакції, що відбуваються під дією світла.
Закон Гроттуса (1818р.): хімічне перетворення речовини може бути спричинено тим світлом, що поглинається цією речовиною. Промені світла, що були відбиті речовиною, або поглинуті нею, не спричиняють ніяких хімічних перетворень. Кількість речовини, що прореагувала під дією поглинутого світла, залежить від мощності світлового потоку, часу опромінення речовини.
Мощність світлового потоку – це кількість енергії. що переносить світловий потік через певну площу перерізу за одиницю часу. Одиниці вимірювання Дж/с.
Для більшості процесів фотохімічна реакція є поштовхом, після якого перебіг реакції не залежить від дії світла.
Промінь світла є електромагнітним випромінюванням певної довжини хвилі λ, частоти коливань ν, маси і енергії фотону ε, що виникає в атомі при переході електронів з більш віддалених від ядра орбіталей, на орбіталі, розміщені ближче до ядра. Цей перехід супроводжується зменшенням енергії (випромінювання), енергія, втрачена атомом, ‑ енергія електромагнітних коливань. Випромінювання або поглинання енергії відбувається частинами – квантами (фотонами).
Енергію фотона ε можна обчислити за формулою: ε = ћ · ν,
де ћ – стала Планка, дорівнює 6,62 · 10-34Дж/с.
Кванти світла – фотони – є матеріальними частинками, які переносять енергію світла. Кожному фотони відповідають певні довжина і частота хвилі, що пов’язані між собою співвідношенням:
![]()
де с = 3 · 108м/c – швидкість світла.
При потраплянні світлової частинки в атом фотон повністю передає йому свою енергію. Якщо запас енергії фотону достатній, то молекула розпадається на окремі атоми, що спричиняє перегрупування атомів і утворення нової сполуки.
Закон фотохімічної еквівалентності Ейнштейна встановлює залежність між кількістю променистої енергії, поглинутої даною речовиною, і кількістю фотохімічно прореагувавши атомів або молекул: число атомів або молекул, які підлягали первинному фотохімічному перетворенню, дорівнює числу поглинутих ними квантів світла.
Квантовий вихід реакції ‑ відношення числа молекул або атомів, які прореагували в результаті сукупності всіх попередніх реакцій, до числа поглинутих квантів (фотонів). Не для всіх реакцій квантовий вихід дорівнює одиниці, оскільки за фотохімічною реакцією проходять реакції в темноті, в результаті яких на один поглинутий фотон припадає декілька молекул продукту (ланцюгова реакція синтезу хлороводню). Якщо квантовий вихід фотохімічної реакції менше одиниці, то відбувається поглинання фотонів іншими речовинами, оборотністю хімічної реакції, передачею енергії в процесі взаємних зіткнень.
Якщо фотохімічні перетворення відбуваються без поглинання випромінювання, то для здійснення таких реакцій необхідно ввести сенсибілізатори, що поглинають енергію. Наприклад, хлорофіл – сенсибілізатор фотохімічних реакцій утворення органічних речовин у зелених рослинах.
Сонячне світло може негативну впливати на якість харчових продуктів. Наприклад при тривалому зберіганні молока на сонячному світлі змінюється вміст вітамінів (крім вітаміну D), молочний жир окислюється, що надає молоку неприємний присмак.
Велика кількість реакцій, які відбуваються в живих клітинах за участю специфічних біокаталізаторів (ферментів та гормонів), мають ланцюговий характер.
Хімічні реакції, які перебігають за участю хімічно активних частинок, вільних атомів чи радикалів з ненасиченою валентністю, а також молекул, іонів або інших частинок, які мають надлишок енергії, називають ланцюговими. Активні частинки зникають і виникають в окремих елементарних актах, ланцюгові реакції складаються із значної кількості стадій, що повторюються.
Ланцюгові реакції мають своєрідний механізм і до них не застосовують закон дії мас.
Закономірності перебігу ланцюгових реакцій:
швидкість ланцюгових реакцій залежить від розміру, форми і матеріалу посудини, в якій знаходиться реакційна суміш;
на швидкість реакцій впливають домішки сторонніх речовин;
швидкість процесу різко зростає у певному інтервалі тиску.
Ланцюгові реакції відбуваються у три стадії:
Зародження (виникнення) ланцюга. Пов’язане з виникненням у системі хімічно активних частинок або активних центрів. Ланцюг зароджується під впливом світла, радіоактивного випромінювання або високої температури, а також завдяки введенню в систему атомів.
Приклад: фотохімічна реакція утворення хлориду водню НСІ починається з того, що молекула СІ2 (або Н2) одержує квант променевої енергії. Це зумовлює розпад молекул на два активні атоми (радикали) СІ∙ (або Н∙).
СІ2 +hν СІ∙ + CІ∙

 W0
W0 Wкр
К1
Wкр
К1
 Wр
Кр
Wр
Кр τр
τ
τр
τ