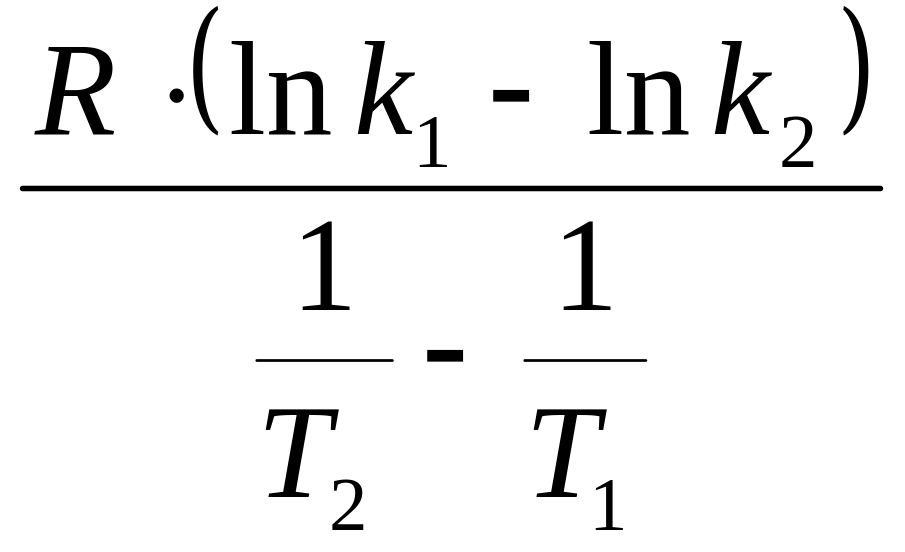- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Вплив температури на швидкість реакції
Визначається правилом Вант-Гоффа (1884): з підвищенням температури на кожні 100 швидкість гомогенних реакцій зростає в 2 – 4 рази.
υ2
= υ1
∙ γ![]() ,
,
де υ1 – швидкість реакції при температурі t1;
υ2 – швидкість реакції при температурі t2;
γ – температурний коефіцієнт реакції (показує, у скільки разів зростає швидкість реакції зі збільшенням температури на кожні 100).
Правило Вант-Гоффа справедливе для інтервалу температур: 273-373К.
Основні положення теорії зіткнень:
Молекули газу повинні зіткнутися, щоб прореагувати.
Швидкість реакції менша, частоти зіткнень.
Під час реакції у взаємодію вступають тільки активні молекули (мають деякий надлишок енергії порівняно з середньою енергією при даній температурі).
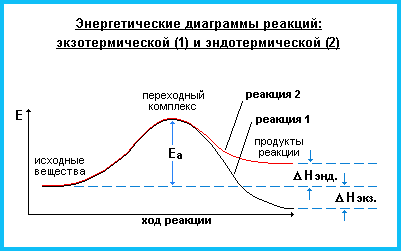
Nакт = N0 ∙ е-Еа/RT, де Nакт – число активних молекул; N0 – загальне число молекул; Nакт < N0; Еа – енергія активації. Енергія активації – це надлишкова енергія порівняно з середньою енергією реагуючих речовин, яку повинні мати молекули, щоб їх зіткнення призводили до хімічної взаємодії. При підвищенні температури частка молекул, енергія яких перевищує значення енергії активації, швидко збільшується. |
|
При хімічній реакції число активних молекул зменшується, проте в результаті перерозподілу енергії частка Nакт / N0 відновлюється.
З підвищенням Т зростає Nакт, збільшується кількість ефективних зіткнень (А акт.), що призводить до збільшення швидкості реакції υ.
|
Еа
=
Енергія активації для більшості процесів змінюється у межах від 50 до 250кДж/моль. Якщо Еа < 40кДж/моль, то реакція відбувається миттєво, якщо Еа = 40 ‑ 120 кДж/моль, то реакція перебігає з певною швидкістю, яку можна виміряти; при Еа > 120кДж/моль швидкість реакції дуже мала. Енергія активації може бути знижена під впливом зовнішніх факторів: збільшення температури, променистої енергії, каталізаторів. |
|
При підвищенні температури частка молекул, енергія яких перевищує значення енергії активації, швидко збільшується. |
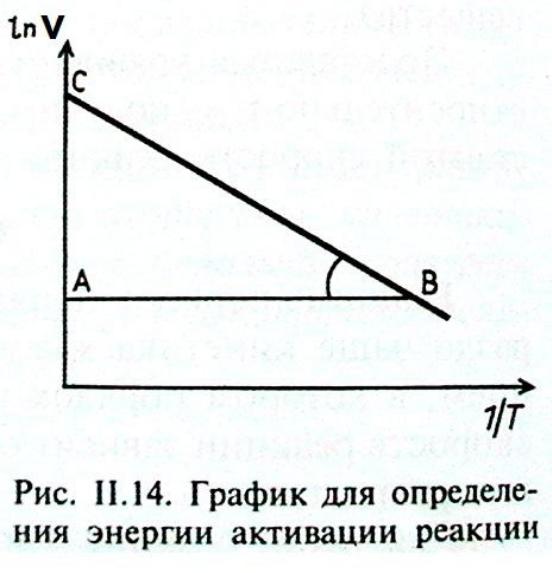
Графік для визначення енергії активації |
|
Під час зіткнення частинки повинні бути певним чином орієнтовані.
Аакт = А0 ∙ е-Еа/RT,
де А0 – загальне число зіткнень;
Аакт – частота співударів молекул, орієнтованих певним чином (активних).
Число зіткнень активних молекул визначає швидкість реакції.
υ0 = κ0, κ = κ0 ∙ е-Еа/RT
ln
κ
= ln
κ0
-
![]() ,
ln
κ0
= ln
A
,
ln
κ0
= ln
A
l n∙κ
= lnA
-
рівняння
Арреніуса
n∙κ
= lnA
-
рівняння
Арреніуса
κ = A ∙ е-Еа/RT – Ea/R – тангенс кута нахилу.
Висновки:
при сталій температурі константа швидкості визначається енергією активації;
чим вища енергія активації, тим менше активних молекул, число ефективних зіткнень і тим нижчою є константа швидкості (швидкість реакції);
важливою умовою здійснення хімічної реакції є розміри, форма частинок, а також орієнтація їх у момент зіткнення;
Ймовірність належної орієнтації при зіткненні характеризує ентропія активації Sa (пропорційна відношенню числа сприятливих способів орієнтації до загального числа способів).
константа швидкості залежить від температури, енергії та ентропії активації (є добутком трьох імовірнісних факторів – числа зіткнень, енергетичного та ентропійного):
κ = Z ∙ е-Еа/RT ∙ еSа/R,
де Z – загальне число зіткнень частинок в одиниці об’єму за одиницю часу;
еSа/R – стеричний фактор.