
- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Зміна швидкості реакції в часі
для реагентів для продуктів
υ
=
t1 t2 t Під час реакції концентрації (реагентів) зменшуються, що призводить до зменшення її швидкості |
|
С C1 < C2
С1
t1 t2 t Під час реакції концентрації продуктів збільшуються, що призводить до зростання її швидкості. |

Швидкість реакції залежить від:
природи реагуючих речовин;
доступності реагентів (ступінь подрібнення твердих реагентів, площа поверхні стикання реагентів);
концентрації реагентів;
температури;
наявності каталізатора.
Залежність швидкості реакції від концентрації реагентів
Визначається законом діючих мас (Гульдберг і Вааге, 1867) – основним законом хімічної кінетики.
Формулювання закону діючих мас: швидкість хімічної реакції пропорційна добуткові концентрацій реагентів.
У загальному випадку для реакції: аА + bВ ↔ сС + dD швидкість реакції дорівнює
υ = κ∙САа ∙ СВb , (кінетичне рівняння гомогенної реакції), де
СА і СВ – концентрації реагентів;
а, b – коефіцієнти в рівнянні реакції;
κ – константа швидкості реакції (швидкість реакції при концентраціях реагентів 1моль/л), характеризує здатність реагентів до взаємодії; характеризує дану реакцію за постійної тмператури.
-
κ залежить від:
• природи реагентів;
• температури;
• наявності каталізаторів.
κ не залежить від:
• концентрацій речовин;
• часу.
Реакції, що відбуваються за однакових умов, порівнюють за їх константами швидкостей.
Закон діючих мас справедливий для:
простих реакцій;
ідеальних газів;
розведених розчинів.
Швидкість гетерогенних реакцій залежить від:
концентрації рідкої або газоподібної речовини;
величини поверхні S твердих реагентів (збільшення S↑ призводить до υ↑, досягається подрібненням);
дифузії (надходження до поверхні твердого реагенту нових порцій реагуючих речовин) – прискорюють струшуванням і перемішуванням.
Молекулярність реакції – число молекул, які беруть участь в елементарному акті взаємодії. Виражається цілим числом, Реакції: мономолекулярні, димолекулярні, тримолекулярні. Одночасне зіткнення в одній точці чотирьох і більше частинок малоймовірне. Молекулярність реакції – поняття теоретичне.
Порядок реакції – сума показників степенів при концентраціях у кінетичному рівнянні реакції. Може змінюватися зі зміною температури та тиску. Для елементарних реакцій збігається з молекулярністю. Для складних реакцій ‑ може бути дробовим, нульовим і навіть від’ємним.
Фактори, які спричиняють різницю між молекулярністю і порядком реакції:
сталість концентрації одного з компонентів реакції в реакційні й суміші;
складана реакція, яка відбувається в декілька стадій, молекулярність і швидкість яких різна;
каталітичні реакції зі складним механізмом, який не відображається стехіометричним рівнянням.
Порядок реакції – експериментальна величина. Визначають за виглядом рівняння, яке відображає експериментальну залежність швидкості даної реакції від концентрації реагуючих речовин.
Тип реакції |
Рівняння хімічної реакції |
Кінетичне рівняння |
Примітка |
Реакція нульового порядку: |
2NH3 → N2 + 3H2 (у присутності вольфраму) |
υ = k∙c0 |
Швидкість не залежить від концентрації реагента (гетерогенні реакції, ферментативні процеси) |
Реакції першого порядку: |
С12Н22О11 + Н2О → 2С6Н12О6 |
υ = κ ∙С (С12Н22О11) |
Реакції ізомерного перетворення, гідролізу |
СН3СОСН3 → СО2 + С2Н4 + Н2О |
υ = κ ∙С (СН3СОСН3) |
||
Реакції другого порядку: |
2Н2О2 → 2Н2О + О2 |
υ = κ ∙ С2 (Н2О2) |
|
2NO → N2О2 |
υ = κ ∙ С2 (NO) |
|
|
Н2 + І2 → 2НІ |
υ = κ ∙ С(Н2) ∙ С(І2) |
|
|
Реакції третього порядку: |
СІ2 + 2NO → 2NOCІ |
υ = κ ∙ С(СІ2)∙С2(NO) |
|
Для гетерогенних реакцій: |
С(тв) + О2 → СО2 |
υ = κ ∙ С(О2) |
Реакція першого порядку |

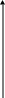 С
C1
> C2
С
C1
> C2
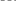
 C1
C1
 С2
С2

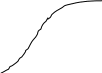 С2
υ
=
С2
υ
=


