
- •5. Методы идентификации веществ. Критерии индивидуальности химического вещества: физико-химические и спектральные. Встречный синтез как метод идентификации вещества.
- •8. Особенности биосинтеза. Биокатализ. Механизм действия ферментов. Практическое применение биосинтеза и биокатализа.
- •12. Получение анилина в промышленности (по Зинину, Перкину, Бешану). Сравнительная характеристика синтеза анилина в промышленности и лабораторных условиях.
- •22 Продолжение Синтоны и синтетические эквиваленты
12. Получение анилина в промышленности (по Зинину, Перкину, Бешану). Сравнительная характеристика синтеза анилина в промышленности и лабораторных условиях.
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 - 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов
C6H5NO2 + 3 H2 → C6H5NH2 + 2 H2O
Впервые окисление нитробензола было произведено с помощью железа:
4 C6H5NO2 + 9 Fe + 4 H2O → 4 C6H5NH2 + 4 Fe3O4
Другим способом получение анилина является восстановление нитросоединений — Реакция Зинина:
Особенности реакции Зинина:
1) эта реакция заключается в восстановлении нитробензола и выражается уравнением:
С6Н5-NO2 + 6Н → С6Н5-NН2 + 2Н2О;
2) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде;
3) восстановление нитросоединений соответствующего строения – это общий способ получения аминов
Производство и применение
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина.
Производство анилина в промышленном масштабе было организовано в 1866 г. шотландским химиком А. Купером. Анилин получали из очищенного нитробензола по схеме А. Бешана. В 1854 г. французским химиком Антуаном Бешаном была открыта реакция восстановления нитробензола железом в слабокислой среде. Этот метод получения анилина, известный как метод Бешана, оказался простым и доступным. Как промышленный метод получения анилина он существует с 1856 г. Достоинствами этого метода являются высокий выход анилина, отсутствие побочных продуктов, дешевизна восстанавливающего агента и простота технологического оформления процесса.
С6Н5NO2 + 3Fe + 4H2O → С6Н5NH2 + 3Fe(OH)2
13. Факторы, определяющие выбор конкретной схемы синтеза: селективность, выход, время, цена, экологичность, токсичность и т.д. Понятие о селективности. Хемоселективность, региоселективность и стереоселективность. Продукто- и субстратоселективность. Факторы, влияющие на селективность химических процессов.
Факторы, определяющие технологичность процесса:
- число и продолжительность стадий; - селективность и постадийные выходы промежуточных и целевого продуктов; - качество и стабильность при хранении промежуточных и целевого продуктов; - возможность полного химического и технического контроля; - сложность используемого оборудования; - температурный режим и энергоемкость процессов; - количество и возможность переработки отходов; - возможность механизации и автоматизации процессов; - возможность регенерации растворителей и других видов сырья.
Экономические факторы:
- доступность и стоимость сырья и материалов; - материальный индекс производства; - трудоемкость процессов; - возможная стоимость оборудования и эксплуатационные затраты; - возможность реализации продукции на рынке; - патентная чистота; - возможность патентной защиты и продажи лицензий;
- возможность экспорта продукции; - возможный масштаб производства; - источники сырья и вспомогательных материалов; - гарантированный спрос на продукцию; - место строительства.
Факторы, определяющие безопасность ( в т.ч. экологическую):
- токсичность, взрыво- и пожароопасность используемых веществ, вопросы охраны труда;
- состав сточных вод и выбросов в атмосферу, вопросы охраны окружающей среды;
- устойчивость и управляемость процессов; - надежность средств регулирования и механизации процессов; - сложность обеспечения безопасности.
Для
иллюстрации ниже приводится схематическое
изображение трех возможных способов
синтеза 3,4-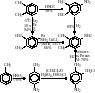 диметиламинобензола
(промежуточного продукта в синтезе
рибофлавина).
диметиламинобензола
(промежуточного продукта в синтезе
рибофлавина).
Сравнение этих схем даже при неполных данных позволяет предположить, что первый метод должен быть малоэффективным,так как уже на первой стадии выход нужного нитроизомера мал, а, следовательно, потребуется разделение и очистка изомеров. Из оставшихся двух методов, вероятно предпочтителен второй (бромирование о-ксилола и аминирование бромксилола), так как для осуществления третьего метода потребуется синтез дихлорметилового эфира из параформа. Кроме того, использование в третьем методе хлорсульфоновой кислоты и электролитического восстановления на свинцовом катоде нетехнологично.
18. Методы синтеза средних, кислых и основных солей. Влияние гидролиза (совместного гидролиза) на результат синтеза неорганических солей в водном растворе. Методы синтеза двойных, смешанных и комплексных солей.
Общие способы синтеза солей.
1.Получение средних солей:
1) металла с неметаллом: 2Na + Cl2 = 2NaCl
2) металла с кислотой: Zn + 2HCl = ZnCl2 + H2
3) металла с раствором соли менее активного металла Fe + CuSO4 = FeSO4 + Cu
4) основного оксида с кислотным оксидом: MgO + CO2 = MgCO3
5) основного оксида с кислотой CuO + H2SO4= CuSO4 + H2O
6) основания с кислотным оксидом Ba(OH)2 + CO2 = BaCO3 + H2O
7) основания с кислотой: Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8) соли с кислотой: MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
9) раствора основания с раствором соли: Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4
10) растворов двух солей 3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl
2.Получение кислых солей:
1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 = KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
3.Получение основных солей:
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
4.Получение комплексных солей:
1. Реакции солей с лигандами: AgCl + 2NH3 = [Ag(NH3)2]Cl
FeCl3 + 6KCN] = K3[Fe(CN)6] + 3KCl
5.Получение двойных солей:
1.Совместная кристаллизация двух солей:
Cr2(SO4) 3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O[
19. Механизмы разрыва и образования химической связи (гомолитический, гетеролитический и перициклический). Типы реагентов в органическом синтезе: радикалы, нуклеофилы, электрофилы; карбены и нитрены. Классификация органических реакций. Рацемические и хиральные реагенты.
Химическая реакция – превращение одних веществ в другие – процесс, связанный с разрывом одних и образованием других, новых связей. Такой разрыв может происходить путем разделения связывающей пары электронов ковалентной связи. Каждый фрагмент (осколок) молекулы получает по одному электрону от прежней пары – это гомолитическое расщепление (гомолиз1):
![]()
Частицы (атомы или группы атомов), имеющие неспаренные электроны, называют радикалами (или свободными радикалами).
Разрыв химической связи, при котором оба связывающих электрона переходят к одной из образующихся частиц, – это гетеролитическое расщепление (гетеролиз):
![]()
Величины энергий гетеролитического расщепления существенно выше, чем гомолитического (на 100 ккал/моль и больше). При гетеролизе нейтральной молекулы образуются положительный и отрицательный ионы, разделение которых требует больше энергии, чем разделение нейтральных частиц. В газовой фазе расщепление связи обычно происходит гомолитически. В ионизирующих растворителях (вода Н2О, спирты RОН, диметилформамид (СН3)2NСНО,диметилсульфоксид (СН3)2S=О), напротив, предпочтительным оказывается гетеролиз.
Классификация реакций по характеру изменения связей (по механизмам)
Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции. Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.
хемагомолитического и гетеролитического разрывов ковалентной связи
Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи:
![]()
Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи
(С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН3• имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов):
СН3 • + • СН3 СН3 : СН3,
Н • + • НН : Н.
19 продолжение Нуклеофильное присоединение (сначала присоединяется CN–, потом Н+):

Электрофильное присоединение (сначала присоединяется Н+, потом Х–):

Элиминирование при действии нуклеофилов (оснований):
![]()
Элиминирование при действии электрофилов (кислот):

перициклические реакции — химические реакции, в которых
реорганизация связей происходит CO2ласованно через циклическую последовательность непрерывно связанных атомов, т. е.
разрыв и образование связей происходит одновременно в полностью
сопряженном циклическом переходном состоянии.
К перициклическим реакциям относятся часть реакций цикло-присоединения (см. выше) и некоторые молекулярные перегруппировки, в том числе электроциклические реакции и сигматропные перегруппировки.
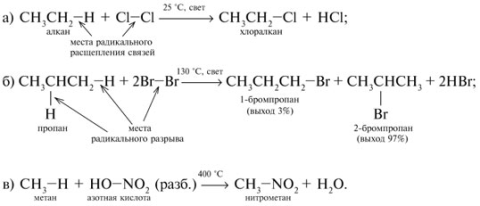
Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов:
Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион:
![]()
К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту.
Реагент – участвующее в реакции вещество с более простой структурой.
Субстрат – исходное вещество с более сложной структурой.
Уходящая группа – это замещаемый ион, который был связан с углеродом.
Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции).
К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями. К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl3, ВF3, FeCl3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи.Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом (+ и –).
Примеры ионных реакций разных типов.
Нуклеофильное замещение:
![]()
Электрофильное замещение:
![]()
22. Понятие о ретроситетическом подходе (Кори). Дизайн и конструирование молекулы органического вещества. Синтоны и ретроны. Принципы расчленения целевых структур на синтоны. Критерии отбора соответствующих синтонам синтетических эквивалентов.
Синтоны, в зависимости от их заряда, подразделяют на а-синтоны (синтоны с акцепторным атомом, имеющим положительный заряд), и d-синтоны (синтоны с донорным атомом, заряженным отрицательно). Аналогично, на атомы а- и d-типа подразделяются атомы С в углеродной цепи, имеющей на одном из концов акцепторную группу. Если углеродная цепь представляет собой полностью сопряженную систему, в ней наблюдается альтернирование донорных и акцепторных атомов:
![]()
В настоящее время считают [7], что такое же альтернирование акцепторных и донорных центров имеется и в насыщенной углеродной цепи с акцепторным атомом на конце:
![]()
Цепь атомов нумеруют, начиная с атома Х, которому приписывают нулевой номер. Синтоны, получающиеся при расчленении такой цепи, могут получить заряды, соответствующие этой "естественной" полярности, например:
![]()
или
![]()
В этом случае говорят о "естественных", или "логичных" синтонах.
Если же заряды синтонов не соответствуют "естественному" альтернированию донорных и акцепторных атомов в углеродной цепи, говорят о синтонах с обращенной полярностью [8], например:
![]()
![]()
