
Кпд тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
![]() .
.
Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
![]() .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
![]() .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины, будет меньше или равен КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Например, КПД идеального цикла Стирлинга равен КПД цикла Карно.
10. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
-
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
-
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно.[5][6]. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. сдиссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
11. Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояниятермодинамической системы.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла ΔQ к величине абсолютной температуры T (то есть тепло, переданное системе, при постоянной температуре):
![]() .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся изменением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине S имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре). Её обобщение на случай произвольного квазистатического процесса выглядит так:
![]() ,
,
где dS — приращение (дифференциал) энтропии некоторой системы, а δQ — бесконечно малое количество теплоты, полученное этой системой.
Необходимо обратить внимание на то, что рассматриваемое термодинамическое определение применимо только к квазистатическим процессам (состоящим из непрерывно следующих друг за другом состояний равновесия).
Поскольку энтропия является функцией состояния, в левой части равенства стоит её полный дифференциал. Напротив, количество теплоты является функцией процесса, в котором эта теплота была передана, поэтому δQ считать полным дифференциалом нельзя.
Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.

Подведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода (определяется лишь начальным и конечным состояниями системы) - для квазистатических процессов неравенство Клаузиуса обращается в равенство[1].

12. Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z, соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = kln Z.
Коэффициент пропорциональности k и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими (Z) и макроскопическими состояниями (S), выражает центральную идею статистической механики.
13.
Учитывая, что плотность распределения
по скоростям ![]() пропорциональна
плотности распределения по импульсам:
пропорциональна
плотности распределения по импульсам:
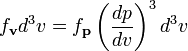
и
используя ![]() мы
получим:
мы
получим:
 ,
,
что
является распределением Максвелла по
скоростям. Вероятность обнаружения
частицы в бесконечно малом элементе ![]() около
скорости
около
скорости ![]() равна
равна
![]()
