
ФИЗИКА ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ.
1.Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состояниитермодинамического равновесия.
В классической статистической механике теорема о равнораспределении кинетической энергии по степеням свободы позволяет связать температуру системы с её средней энергией. Эта теорема также известна под названиямизакон равнораспределения и теорема о равнораспределении. В первоначальном виде теорема равнораспределения утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняякинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии еёвращательного движения.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового,механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния.
Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний.
2. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с ихкинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
-
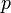 — давление,
— давление, -
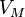 — молярный
объём,
— молярный
объём, -
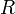 — универсальная
газовая постоянная
— универсальная
газовая постоянная -
 — абсолютная
температура,К.
— абсолютная
температура,К.
|
|
Газовая постоянная |
8.314472(15) Дж/(К·моль) |
|
|
|
|
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) |
|
||||
|
Изменение внутренней энергии газа |
|
||||
|
Работа газа |
|
||||
|
Средняя энергия молекулы газа |
|
||||
|
Средняя кинетическая энергия молекулы газа: |
|
||||
|
Внутренняя энергия газа |
|
||||
3. Внутренняя энергия
Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами:
![]() .
.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Согласно закону
Джоуля,
выведенному экспериментально, внутренняя
энергия идеального
газа не
зависит от давления или объёма газа.
Исходя из этого факта, можно получить
выражение для изменения внутренней
энергии идеального
газа. По определению молярной
теплоёмкости при
постоянном объёме, 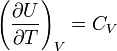 [13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то
[13].
Так как внутренняя энергия идеального
газа является функцией только температуры,
то
|
где:
![]() —
число
молей идеального газа.
—
число
молей идеального газа.
4. Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основныхтермодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единицы измерения: Джоули Дж
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
Механическая работа — это физическая величина, являющаяся скалярной количественной мерой действия силы или сил на тело или систему, зависящая от численной величины и направления силы(сил) и от перемещения точки(точек) тела или системы.[1].
Термодинамическая работа — количество энергии, переданной или полученной системой путём изменения её внешних параметров.
5. Рассмотрим несколько частных случаев:
-
Если δQ > 0, то это означает, что тепло к системе подводится.
-
Если δQ < 0, аналогично — тепло отводится.
-
Если δQ = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая:
в конечном процессе ![]() элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда δA' = 0, δQ = 0, dN = 0, выполнение системой работы δA приводит к тому, что ΔU < 0, и энергия системы Uубывает. Поскольку запас внутренней энергии U ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
-
при изобарном процессе
![]()
-
при изохорном процессе (A = 0)
![]()
-
при изотермическом процессе (ΔU = 0)
![]()
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
6. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
Молярная теплоемкость — теплоемкость 1 моля идеального газа.
![]()
![]()
Формула
расчёта удельной теплоёмкости: ![]() ,
где
,
где ![]() —
удельная теплоёмкость,
—
удельная теплоёмкость, ![]() — количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении),
— количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении), ![]() —
масса нагреваемого (охлаждающегося)
вещества,
—
масса нагреваемого (охлаждающегося)
вещества, ![]() —
разность конечной и начальной температур
вещества.
Уде́льная теплоёмкость (Удельная
теплота нагревания на один градус,
обозначается как c)
вещества определяется как
количество тепловой энергии,
необходимой для
повышения температуры одного килограмма вещества
на один градус.
—
разность конечной и начальной температур
вещества.
Уде́льная теплоёмкость (Удельная
теплота нагревания на один градус,
обозначается как c)
вещества определяется как
количество тепловой энергии,
необходимой для
повышения температуры одного килограмма вещества
на один градус.
8. Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёттепловой энергии.
Если термодинамический процесс в общем случае являет собой три процесса - теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии[4], то адиабатический процесс в силу отсутствия теплообмена (ΔQ = 0) системы со средой сводится только к последним двум процессам[5]. Поэтому, первое начало термодинамики в этом случае приобретает вид[6][7]:
![]() ,
где
,
где ![]() —
изменение внутренней
энергии тела,
—
изменение внутренней
энергии тела, ![]() — работа,
совершаемая системой,
— работа,
совершаемая системой, ![]() —
теплота, полученная системой.
—
теплота, полученная системой.
Энтропия (S) системы в обратимом адиабатическом процессе не меняется [8]:
![]() ,
где T - температура системы.
,
где T - температура системы.
Благодаря
этому адиабатический процесс может
быть составной частью обратимого
цикла[8].![]()
9. Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной машины описывается циклом Карно.
При работе часть тепла Q1 передается от нагревателя к рабочему телу, а затем часть энергии Q2 передается холодильнику, который охлаждает машину КПД тепловой машины считается по формуле (Q1-Q2/Q1)х100
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной.
Пусть тепловая машина состоит из нагревателя с температурой TH, холодильника с температурой TX и рабочего тела.
Цикл Карно состоит из четырёх стадий:
-
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру TH, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается.
-
Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
-
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру TX, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты QX.
-
Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
 при δQ =
0.
при δQ =
0.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
