
- •Цель работы
- •Описание объекта
- •Качественный анализ
- •Количественный анализ Гравиметрические методы анализа
- •Титриметрические методы анализа
- •Обоснование выбора методики
- •Экспериментальная часть Гравиметрическое определение олова
- •Ход анализа
- •Титриметрическое определение свинца
- •Ход анализа
- •Используемая литература
Титриметрические методы анализа
При титриметрическом определении олова с индикаторным фиксированием точки эквивалентности обычно используют изменение валентности олова или образование малодиссоциированных соединений.
Йодометрическое определение олова проводят в кислой среде согласно реакции:
Sn2+ + I2 + 4Cl- = SnCl4 + 2I-
Перед титрованием олово восстанавливают металлическим свинцом или никелем. Методика данного способа достаточно неудобна, так, например, титрование необходимо проводить в атмосфере СО2 во избежание окисления олова(II) кислородом воздуха.
Суть йодатометрического определения состоит в титровании йодатом калия раствора олова(II) в слабокислой среде.
3Sn2+ + IO3- + 6H+ = 3Sn4+ + I- + 3H2O
В качестве индикатора используют крахмал, поскольку после точки эквивалентности избыточный йодат калия реагирует с ионами йода, образуя I2.
Прямое титрование раствором ЭДТА раствора олова(II) ведут при рН 5,5-6 в присутствии метилтимолового синего, а раствора олова(IV) при рН 1,8 в присутствии ксиленового оранжевого.
Йодометрический метод определения свинца заключается в том, что свинец из раствора осаждают сначала в виде сульфата, потом хромата, после чего растворением в солянной кислоте получают хромовую кислоту и прибавляют йодид калия, выделившийся иод оттитровывают раствором тиосульфата натрия.
2PbCrO4 + 4HCl = 2PbCl2 + H2Cr2O7 + H2O
H2Cr2O7 + 6KI +12HCl = 2CrCl3 + 6KCl + 3I2 + 7H2O
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
В сравнении с предыдущей методикой титрование раствора свинца раствором ЭДТА сводится к меньшему числу стадий, что существенно облегчает работу. Как правило, такое титрование проводят в слабокислой среде используя в качестве индикатора 4- (2-пиридилазо) – резорцин или кселеноловый оранжевый, или в щелочной среде с эриохромом черным Т.
Обоснование выбора методики
Возможны два способа работы с пробой: 1) растворить навеску сплава точно известной массы, и далее разделить основные компоненты с последующим гравиметрическим и титриметрическим определением; 2) титриметрическое и гравиметрическое определение проводить из двух отдельных навесок. В данной работе был выбран первый способ, так как при растворении сплава в азотной кислоте в осадок количественно выпадает один из двух определяемых элементов (Sn в виде β-оловянной кислоты).
Согласно краткому обзору методик β-оловянная кислота является осаждаемой формой при определении олова гравиметрическим методом. Следует отметить, что в данной работе не проводилась отгонка олова в виде летучих галоидных соединений в силу того, что количество примесей пренебрежимо мало и летучие соединения олова токсичны.
Комплексонометрическое определение олова удобно проводить в слабокислой среде, используя индикатор ПАР.
Выданный образец представляет собой сплав баббит с приблизительным содержанием компонентов: Pb (70%) и Sn (30%)
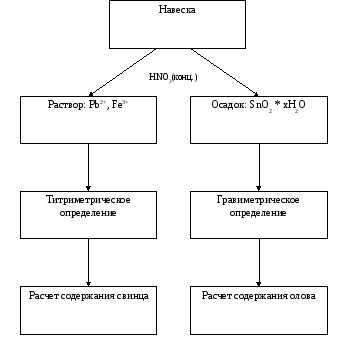
При определении из одной навески важно учитывать соотношение массы гравиметрической формы и концентрации титруемого вещества. Так, при получении SnO2 массой 0,1г концентрация Pb2+ в растворе будет ~0,01М, т.е. при хорошей гравиметрической форме будет слишком маленькая концентрация второго иона. И обратно, если концентрация раствора свинца будет равна 0,05М, то масса гравиметрической формы увеличится до ~0,6 г, соответственно объем осаждаемой формы будет слишком большой.
В этой работе за ориентир была взята концентрация Pb2+ равная 0,035М.
Тогда
n = CPb2+ * Vколбы= 0,035 * 0, 1 = 0,0035 моль
mPb = n * M = 0,0035 * 207 = 0,7245 г
mSn = mPb * 30 / 70 = 0,3105 г
mSnO2 = mSn / Г = 0,3105 / 0,7877 = 0,3942 г
