
- •Основные виды материи:
- •Квантовые поля
- •Связь с термодинамической устойчивостью системы
- •Энергия Гиббса и направление протекания реакции
- •Уравнение Гиббса, экстенсивность и уравнение Гиббса — Дюгема
- •Гомогенные и гетерогенные реакции
- •Факторы, влияющие на скорость химических реакций.
- •Примеры
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Массовая доля (также называют процентной концентрацией)
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Моляльность (молярная весовая концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Титр раствора
- •Мольная (молярная) доля
- •Другие способы выражения концентрации растворов
- •61 Вывод значения ионного произведения воды
Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
V = k • [A]a • [B]b • . . .
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Температура. При повышении температуры на каждые 10C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
|
|
|
(t2 - t1) / 10 |
|
Vt2 / Vt1 |
= |
|
(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; - температурный коэффициент данной реакции).
Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
Билет №22
Теория строения атома. История развития учения о строении атома.
Мысль о том, что вещество построено из мельчайших “кирпичиков” высказывалась еще древнегреческими учеными. Более двух тысяч лет тому назад в столице древней Греции Афинах жил знаменитый философ Анаксагор. Он учил, что все вещи построены из первичных мельчайших частиц – “семян”. По обвинению в безбожии Анаксагор был выслан из Афин и умер в ссылке.
Однако идеи Анаксагора развили его последователи – Левкипп и Демокрит. Они сделали гениальную попытку объяснить строение мира, не прибегая ни к каким сверхъестественным обоснованиям. Итак, с точки зрения Демокрита и Левкиппа вселенная состоит из пустого пространства и бесконечного множества мельчайших частиц – атомов, одинаковых по своим свойствам и движущихся без всякой видимой причины. Существует предел деления атомов.
Решающим моментом в развитии теории строения атома было открытие электрона.
Наличие в электрически нейтральном атоме отрицательно заряженной частицы побуждало предполагать наличие частицы с положительным зарядом. Одна из первых моделей атома была предложена в 1904 году Дж. Томсоном. Согласно модели,атом представлял собой нейтральную систему, состоящую из заряженного шара с зарядом +Ze, внутри которого в определенных равновесных положениях находятся Z отрицательно заряженных электронов. Размер атома ~10-8 см. Модель Д. Томсона, не будучи в состоянии объяснить характер атомных спектров, излучаемых атомами, уступила место планетарной модели Э. Резерфорда.
Резерфорд.Атом состоит не из положительно заряженного облака, в котором (подобно изюму в булке) находятся электроны, как это предполагал Д. Томсон, а из электрона и ядра размером около 10-13 см., в котором сосредоточена почти вся масса атома. Атом подобен Солнечной системе: в центре него находится тяжелое ядро, вокруг него вращаются электроны.
Но подобный атом не может быть устойчивым, а потому в реальности не может существовать. Таким образом, классическая физика не могла найти объяснения устойчивости атомов.
Разработка следующей модели атома принадлежит Н. Бору. Взяв за основу модель Резерфорда, он использовал и идеи квантовой теории. Бор выдвинул предположение, согласно которому в атомах существуют особые стационарные состояния, в которых электроны не излучают - излучение происходит лишь при переходе из одного стационарного состояния в другое.
Для модели атома Бора основополагающим является утверждение о том, что электроны внутри атома могут находиться лишь в стационарных состояниях, которые соответствуют определенным квантовым значениям энергии. Следовательно, существуют определенные энергетические уровни, на которых находятся электроны
Согласно современным представлениям атомы имеют сложное строение. Они состоят из ядра и электронов.
Как выяснили ученые, ядро тоже имеет сложное строение. Оно состоит, главным образом, из двух видов частиц протонов и нейтронов.
Протоны имеют заряд +1 и массу, приблизительно равную 1 (в атомных единицах массы, а.е.м.).
Нейтрон не имеет заряда, а его масса тоже примерно равна 1 а.е.м.
Число протонов в ядре соответствует порядковому номеру химического элемента. Количество нейтронов равно числу протонов или чуть больше.
Билет №23
Двойственная природа электрона. Уравнение Луи-де-Бройля. Доказательства корпускулярного и волнового существования электрона.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Формула
де Бройля устанавливает
зависимость длины волны λ, связанной
с движущейся частицей вещества, от
импульса
p
частицы:
![]()
где m — масса частицы, v — ее скорость, h — постоянная Планка. Волны, о которых идет речь, называются волнами де Бройля.
Корпускулярно-волновой дуализм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций.
В частности, свет — это и корпускулы (фотоны), и электромагнитные волны. Свет демонстрирует свойства волны в явлениях дифракции и интерференции при масштабах, сравнимых с длиной световой волны. Например, одиночные фотоны, проходящие через двойную щель, создают на экране интерференционную картину, определяемую уравнениями Максвелла. Тем не менее, эксперимент показывает, что фотон не есть короткий импульс электромагнитного излучения, например, он не может быть разделён на несколько пучков оптическими делителями лучей. Корпускулярные свойства света проявляются при фотоэффекте и в эффекте Комптона. Фотон ведет себя и как частица, которая излучается или поглощается целиком объектами, размеры которых много меньше его длины волны (например, атомными ядрами), или вообще могут считаться точечными (например, электрон).
Билет№24
Волновое
уравнение Э.Шредингера. Квантовые
числа. Волновая функция![]() . Радикальная и угловая ее составляющие.
Понятие атомной орбитали.
. Радикальная и угловая ее составляющие.
Понятие атомной орбитали.
Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Атомная орбиталь (АО) – область пространства вокруг ядра атома, в которой вероятность пребывания электрона достаточно высока (90%). Понятие «атомная орбиталь» связывает представления Бора об орбитах – траекториях с современными квантово – механическими представлениями о вероятностном характере движения электрона в атоме. Атомную орбиталь иногда рассматривают как электронное облако, представляющее собой наглядное изображение электрона, делокализованного в объеме атома. Атомные орбитали отличаются друг от друга размерами, формой, ориентацией в пространстве. Существуют следующие формы атомных атомных орбиталей:
![]() Сферическая
S – орбиталь.
Сферическая
S – орбиталь.
![]() Гантелеобразная
p – орбиталь .
Гантелеобразная
p – орбиталь .![]() Четырехлопастная
f – орбиталь.
Четырехлопастная
f – орбиталь.
Билет№25
Квантовые числа. Их физический смысл. Численные значения.
Главное квантовое число характеризует энергию электрона в атоме.
Принимает положительные целочисленные значения от 1 до бесконечно малых чисел: n=1, 2, 3 ….до бесконечности.
Определяет характер радиальной зависимости орбитали, т.е размеры электронного облака.
Другими словами, n определяет средний радиус нахождения электрона в атоме.
Орбитальное квантовое число определяет угловую зависимость волновой функции, т.е формулу электрического облака l=0, 2, 3, …., (n-1)
Магнитное квантовое число определяет возможные ориентации электронного облака в пространстве ml=-l, …, -2, -1, 0,1, 2, …,l.
Спинавое квантовое число отражает наличие у электрона собственного момента движения ms= 1/2 или -1/2
Билет №26
-
В пределах одного периода с возрастанием порядкового номера химических элементов:
А). Заряд ядра растет, а радиус атома уменьшается.
Б). Число электронов на верхнем слое растет от 1 до 8.
В). Число энергетических уровней постоянно.
Г). Так как радиус атома уменьшается, то электрон наружного слоя легче притягиваются к ядру.
Отдача электрона (от 1 до 3) – уменьшается.
Принятие электрона (от 1 до 4) – увеличивается.
Вывод: В пределах 1 периода с возрастанием порядкового номера химических элементов, принятие электронов уменьшается, а отдача увеличивается.
-
В пределах одной группы, главной подгруппы с возрастанием порядкового номера или заряда ядра:
А). Растет число энергетических уровней.
Б). Растет радиус атома.
В). Число электронов на наружном слое одинаково.
Г). Так как радиус атома увеличивается, то отдача электронов с наружного слоя увеличивается, а притяжение электронов уменьшается.
Отсюда: металлические свойства усиливаются, а неметаллические уменьшаются.
Билет № 28
ВОЗБУЖДЕНИЕ АТОМА - квантовый переход атома или молекулы с более низкого (напр., основного) уровня энергии на более высокий при поглощении ими фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами (возбуждение ударом).
Возбуждение атомов в столкновениях с ионами и др. атомами эффективно при кинетич. энергии сталкивающихся частиц ~100 эВ и выше. При меньших энергиях они крайне малы и в области пороговых энергий экспериментально не наблюдались. Качеств. подобие сечений межатомных столкновений сечениям электронно-атомных столкновений реализуется в масштабе скоростей относит. движения - при скоростях порядка и больше скоростей орбитальных электронов. При меньших скоростях (т. н. медленных столкновениях) механизм возбуждения объясняется образованием квазимолекулы в процессе столкновения и переходом электронов между молекулярными уровнями энергии.
Возбуждение атомов, ионов и молекул электронным ударом является ключевым элементарным процессом, определяющим основные свойства плазмы. Процессы возбуждения частиц при столкновении с электронами участвуют в установлении равновесия в плазме и в формировании функции распределения плазмы и электронов, определяют излучение плазмы и уширение спектральных линий. Возбуждение молекул в отталкивательные состояния сопровождается их диссоциацией, что определяет концентрации различных атомарных частиц. Возбуждение частиц в метастабильные состояния приводит к формированию обратной заселенности уровней, что стимулирует излучение. Кроме того, столкновения электронов с молекулами сопровождаются колебательными и вращательными возбуждениями, что также играет важную роль в плазменной кинетике.
Гибридизация атомных орбиталей
При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга.
При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
Билет №29
Атом (от греч. atomos — неделимый), частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род Атом, обозначаемых символом элемента (например, Атом водорода Н: Атом железа Fe; Атом ртути Hg; Атом урана U).
Атом могут существовать как в свободном состоянии, в газе, так и в связанном. Соединяясь химически с Атом того же элемента или Атом других элементов, они образуют более сложные микрочастицы — молекулы, всё огромное многообразие химических соединений обусловлено различными сочетаниями Атом в молекулах. Связываясь друг с другом непосредственно .или в составе молекул, Атом образуют жидкости и твёрдые тела.
Свойства макроскопических тел — газообразных, жидких и твёрдых — и свойства отдельных молекул зависят от свойств входящих в их состав Атом Все свойства Атом, физические и химические, определяются его строением как системы, состоящей из ядра и электронов, и подчиняются характерным для микроскопических явлений квантовым законам. Ниже излагаются современные представления о строении и свойствах Атом (историю развития учения об Атом см. в ст. Атомная физика).
Общая характеристика строения атома. Атом состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки Атом Размеры Атом в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра Атом /
Заряд ядра — основная характеристика Атом, обусловливающая его принадлежность определённому элементу. Заряд ядра всегда является целым кратным элементарного положительного электрич. заряда е, равного по абсолютному значению заряду электрона —е. Заряд ядра равен +Ze, где Z — порядковый номер (атомный номер). Z = 1, 2, 3, 4,... для Атом последовательных элементов в периодической системе элементов Менделеева, т. е. для атомов Н, Не, Li, Be, ...В нейтральном Атом ядро с зарядом +Ze удерживает Z электронов с общим зарядом —Ze и полный заряд Атом равен нулю; в положительном ионе —Атом, потерявшем k электронов (ионизованном Атом), остаётся Z—k электронов (k = 1, 2, 3, ... — кратность ионизации) и его заряд равен +ke, в отрицательном ионе —Атом, присоединившем k электронов,— содержится Z + k электронов, и его заряд равен —ke. Для положительного иона максимальное значение k = Z (такой ион потерял все свои электроны и состоит из «голого» ядра); для отрицательного свободного иона k = 1, для связанных Атом возможно образование отрицательных ионов с k > 1 (в растворах, комплексных соединениях и ионных кристаллах). Говоря об Атом определённого элемента, подразумевают как нейтральные Атом, так и ионы этого элемента. Но иногда под Атом понимают нейтральный Атом, в противоположность ионам. Положительные и отрицательные ионы при написании отличают от нейтрального Атом индексом k+ и k—, например О обозначает нейтральный Атом кислорода (Z = 8), О+, О2+(или O++), O3+,..., O8+ — его положительные ионы,О—, O2— (или О— — его отрицательные ионы. Совокупность нейтрального Атом и ионов других элементов с тем же числом электронов образует изоэлектронный ряд. Простейший такой ряд начинается с Атом водорода: H, He+, Li2+, Be3+, ...; члены этого ряда состоят из ядра и одного электрона.
Порядок значений зарядов ядер различных Атом был определён английским физиком Э. Резерфордом в его первоначальных опытах по рассеянию альфа-частиц (1911). Значения Z были надёжно установлены английским физиком Г. Мозли (1913—14) на основе изучения рентгеновских спектров последовательных элементов в периодической системе. Кратность заряда ядра Атом элементарному заряду е получила объяснение, исходя из представлений о строении ядра: Z равно числу протонов в ядре, протон имеет заряд +е, и полный заряд ядра равен сумме зарядов всех Z протонов, т. е. +Ze.
Масса атома возрастает с увеличением Z. Масса ядра Атом приближённо пропорциональна массовому числу А — общему числу протонов и нейтронов в ядре. Масса электрона (0,91 10—27 г) значительно меньше (примерно в 1840 раз) массы протона или нейтрона (1,67 10—24 г), и поэтому масса Атом в целом определяется в основном массой его ядра.
Атом данного элемента могут отличаться массой ядра (число протонов Z постоянно, число нейтронов А—Z может меняться); такие разновидности Атом одного и того же элемента называются изотопами. Различие массы ядра почти не сказывается на строении их электронных оболочек, зависящем от заряда ядра Z. Химические и большинство физических свойств (оптические, электрические, магнитные), определяемые строением электронных оболочек, одинаковы или очень близки для всех изотопов данною элемента. Наибольшие отличия в свойствах (изотонические эффекты) получаются для изотопов водорода (Z = 1) из-за большой разницы в массах обычного лёгкого Атом водорода (А = 1), Атом дейтерия (А = 2) и Атом трития (А = 3).
Масса Атом приближённо равна массовому числу А и изменяется от 1,67 10—24 г для самого лёгкого Атом водорода (основного изотопа: Z = 1, A = 1) до примерно 4 10—22 г для самых тяжёлых Атом трансурановых элементов (Z = 100, А = 250).
Наиболее точные значения масс Атом могут быть определены методами масс-спектроскопии. Масса Атом не равна в точности сумме массы ядра и масс электронов, а несколько меньше — на дефект массы DМ = W/c2", где W — энергия образования Атом из ядра и электронов, а с — скорость света. Эта поправка — порядка массы одного электрона mе для тяжёлых Атом, а для лёгких Атом пренебрежимо мала (порядка 10—4 массы электрона).
Билет №30
Строение ядра.
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом - нейтральная частица, не несущая заряда.Атом может потерять один или несколько электронов или наоборот - захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика - порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн! Внешние размеры атома - это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона.Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами.
Изотопы.Изотоны.Изобары
Изотопами называются вещества, состоящие из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре. Изотопы отличаются друг от друга только массовым числом. Все элементы состоят из одного или нескольких изотопов.
Изотонами
называются атомы разных элементов,
имеющие одинаковое количество нейтронов
в ядре. Примером изотонов могут служить
нуклиды
![]() и
и
![]() ,
имеющие по 7 нейтронов.
,
имеющие по 7 нейтронов.
Изоба́ры— нуклиды, имеющие одинаковое массовое число; например, изобарами являются 40Ar, 40K, 40Ca. Хотя массовое число (т. е. число нуклонов) A = N + Z в ядрах-изобарах одинаково, числа протонов Z и нейтронов N различаются
Радиоактивный распад.
Радиоактикностью называется самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента,сопровождающееся испусканием элементарных частиц или ядер.
Естественная радиоактивность — Радиоактивность,проявляемая природными изотопами элементов
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции.
Проессы радиоактивных превращений протекают у разных изотопов с различной скоростью.Эта скорость характеризуется постоянной радиоктивного распада,показывающей какая часть общего числа атомоврадиоактивного изотопа распадается в 1с.чем больше радтоактивная постоянная,тем быстрее распадается изотоп.
Изучение процессоврадиоактивного распада показало,что количество атомоврадиоактивного изотопа,распадающихся в еденцу времени пропорционально имеющемуся в данный момент общему количеству атомов этого изотопа.
Билеты №31
Химическая связь и строение молекул.
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Молекула-это некоторая совокупность атомов,которая обладает рядом характерных отличительных свойств.
Характерные свойства молекулы-такие свойства,которые позволяют её идентифицировать.К ним относятся качественный и количественный состав,пространственное расположение атомов,энэргия взаимодействия атомов и др.
Молекула состоит из двух или более атомов, характеризуется количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены); заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (то есть с неспаренными электронами и ненасыщенными валентностями) — радикалами.
Молекулы, образованные сотнями или тысячами атомов, называются макромолекулами. Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Ковалентная неполярная связь.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
-
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
«Потенциальная яма» при образовании молекул водорода.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантовомеханические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Билет №34
Кислород имеет восемь электронов, наиболее активны те из них (1, 2), что расположены на оси симметрии. Шесть других электронов, расположенных в плоскости перпендикулярной осевой линии (линии симметрии), своим суммарным электрическим полем удаляют электроны 1 и 2 от ядра на большее расстояние, формируя условия для большей их активности при взаимодействии с электронами соседних атомов [1].
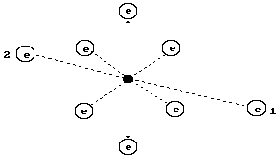
Билет № 35
1.Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость .
А) Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. (Углы между двумя связями называют валентными.)
Б) Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. ( Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.)
В) Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Г) Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. ( Поляризуемость определяется подвижностью электронов. )
2.
Ковалентная неполярная связь-это связь, при которой обобществленные электроны равномерно распределены между одинаковыми атомами.
Ковалентная полярная связь-это связь, при которой один из атомов сильнее притягивает электроны и электронная пара смещается в сторону одного атома.
Билет №36
Ионная связь. Свойства ионной связи. Степень ионности.
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности ЭО атомов, например между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов VI или VII групп ( LiF, CsCl , K2O и др.)
При образовании катионов и анионов могут возникать устойчивые октетные электронные конфигурации. Атомы и ионы с одинаковыми электронными конфигурациями образуют изоэлектронные ряды, например, ряды иона, аргона, криптона.
Т.к. электрическое поле иона имеет сферический характер, то для ионной химической связи не характерна направленность . Ионной связи так же не свойственна насыщаемость,так как ион способен взаимодействовать со многими соседними ионами противоположного знака, число которых зависит от зарядов ионов и соотношений геометрических размеров. Ионная химическая связь проявляется в твердых веществах, с ионной кристаллической решеткой . Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разностью ЭО. Поэтому и чисто ионная связь не существует. Можно лишь говорить о доле ионности связи.
Билет №37
Донорно-акцепторная связь.
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, вид ковалентной связи, осуществляемый за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Донорно-акцепторный механизм возникает часто прикомплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору) и обобществляемой при образовании связи. Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связующих электронов. Например, реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленной электронной паре донора (азота): В ионеNH4+ все четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов может выполнять протон, а также атомы с незаполненнымоктетом (напр., атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое).
Билет №39
Водородная связь. Межмолекулярное взаимодействие или силы Ван-дер-Ваальса. Виды межмолекулярного взаимодействия ( ориентационное, индукционное, и дисперсионное).
Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H,ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H•••BR' различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR'.Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.Ранее образование водородной связи обычно объясняли действием электростатических сил, то есть атом водорода, несущий слабый положительный заряд, притягивается к электроотрицательному атому, который несет небольшой отрицательный заряд. Теперь ученые склоняются к тому, что водородная связь может быть частично ковалентной - это означает, что при ее формировании происходит обобщение электронов водорода и второго образующего связь атома.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. ОткрытыЯ. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
-
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
-
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
-
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным(индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
-
Билет №41
-
Металлическая связь и ее особенности. Внутреннее строение металлов. Три основных типа пространственных кристалллических решеток ( обьемно-центрированная кубическая, гранецентрированная кубическая, гексагональная решетка плотной упаковки)
-
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов иинтерметаллических соединений.Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов:кубическую объемно центрированную,кубическую гранецентрированную и гексагональную
-
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni,Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решетке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с плаcтичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Билет №51
Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.
Химический раствор — это смесь одной или нескольких кислот с водой.
Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов[1].
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает[1].
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
