
Obsh_chemical_1
.pdfМинистерство образования Российской Федерации Красноярская государственная архитектурно-строительная академия
ОБЩАЯ ХИМИЯ
Методические указания к лабораторным работам для студентов первого курса всех специальностей
Часть I
Красноярск, 1999

Общая химия: Методические указания к лабораторным работам для студентов первого курса всех специальностей. Часть I. - Красно ярск: КрасГАСА, 1999. 36 с.
Составили: Владимир Петрович Киселев Александр Васильевич Иванченко Лев Павлович Шишин Галина Тимофеевна Тюменева
Людмила Александровна Рубчевская
Печатается по решению редакционно-издательского совета академии
 Красноярская государственная архитектурно-строительная академия, 1999
Красноярская государственная архитектурно-строительная академия, 1999
3
ЛАБОРАТОРНАЯ РАБОТА № I.
ПРИГОТОВЛЕНИЕ РАСТВОРОВ. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ
Цель работы: ознакомиться со способами выражения концентрации рас творов; научиться определять концентрацию раствора, приобрести на выки приготовления растворов заданной концентрации.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Раствором называется многокомпонентная гомогенная система пе ременного состава.
Растворы могут быть газовыми, жидкими и твердыми. Обычно тер мин "раствор", не содержащий уточнений, относится к жидкой гомо генной системе.
Раствор состоит из растворителя и растворенного вещества. Рас творителем обычно называют тот компонент раствора, содержание кото рого больше. Относительное содержание компонентов раствора характе ризуется его концентрацией.
Существуют следующие способы выражения концентрации.
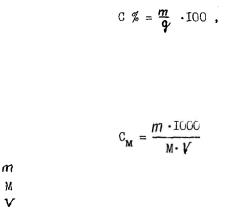
Процентная концентрация С % или массовая доля растворенного вещества показывает, сколько весовых частей растворенного вещества содержится в 100 весовых частях раствора, единица измерения - %.
где 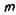 - масса растворенного вещества, г;
- масса растворенного вещества, г;
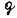 - масса раствора, г.
- масса раствора, г.
Молярная концентрация См показывает число молей растворенного вещества в I л раствора, единица измерения - моль/л.
|
» |
где - масса растворенного вещества, г; |
|
- |
молярная масса растворенного вещества, г/моль; |
- |
объем раствора, мл. |
Эквивалентная или нормальная концентрация Сн показывает число эквивалентных масс растворенного вещества в I л раствора, единица измерения - моль/л.

где т - масса растворенного вещества, г;
Э - |
эквивалентная масса растворенного вещества, г/моль; |
V - |
объем раствора, мл. |
Титр раствора Т показывает число граммов растворенного вещес тва в I мл раствора, единица измерения - г/мл.
Важной характеристикой раствора является его плотность d , единицы измерения - г/мл. кг/м .
где m |
- масса раствора, |
г; |
V - объем раствора, |
мл. |
|
В справочниках приводятся соотношения между плотностями неко |
||
торых растворов и их концентрациями. |
||
При химических расчетах часто приходится переходить от одног |
||
способа |
выражения концентрации к другому. Рассмотрим принцип пере |
|
счета концентраций на примерах. Пример I.
Пересчитать 20 %-ный раствор серной кислоты плотностью 1,145 г/мл на молярную и нормальную концентрации. Определить титр этого раствора.
Решение.
Находим содержание серной кислоты в I л (1000 мл) раствора:
Определяем
Рассчитываем молятаость раствора: Находим титр:

Пример 2. |
|
Рассчитать процентную концентрацию 2 н раствора |
аОН плотно |
стью 1,08 г/мл. Решение.
Определяем массу растворенного вещества в I л раствора:
Находим процентную концентрацию раствора:
Оборудование и реактивы: мерный цилиндр, ареометр, конические колбы на 100 мл, мерная колба на 100 мл, пипетки, капельницы с ин дикатором метиловым оранжевым, бюретка, титрованный раствор NаОН (Сн = 0,1), раствор серной кислоты.
ХОД РАБОТЫ
Опыт I. Определение процентной концентрации раствора с по мощью ареометра. Приготовление раствора заданной нормальной кон центрации .
а) Требуется с помощью ареометра и справочных данных опреде лить С % имеющегося в лаборатории раствора серной кислоты. Для этого налейте исходную кислоту в цилиндр, осторожно опустите туда ареометр, чтобы он не касался дна и стенок цилиндра. Отметьте де ление шкалы ареометра, совпадающее с нижним мениском жидкости в ци линдре. Это и есть плотность данного раствора (p). По табл.1 определите процентную концентрацию данного раствора кислоты.
Таблица I
С % | / , г/мл С % |
J>, г/мл С % |
i>, г/мл С % |
, г/мл| С % |
$, г/мл |
|||||
0 |
0,998 |
6 |
1.638 |
16 |
1,109 |
40 |
1,303 |
76 |
1,631 |
I |
1,005 |
7 |
1,045 |
19 |
1,132 |
46 |
1,357 |
82 |
1,749 |
2 |
1,012 |
8 |
1,052 |
22 |
1,155 |
52 |
1,415 |
88 |
I.8L2 |
3 |
1,018 |
9 |
1,059 |
25 |
1,178 |
58 |
1,477 |
94 |
1,831 |
4 |
1,025 |
10 |
1,066 |
31 |
1,227 |
64 |
1,542 |
9? |
1,836 |
5 |
1,032 |
13 |
1,087 |
34 |
1,252 |
70 |
1,611 |
100 |
I , &,0 |
|
|
||||||||
|
Если измеренное значение плотности не совпадает с табличным, |
||||||||
то |
значение |
концентрации |
находят методом интерполяции, считая за- |
||||||
b
висимость плотности от концентрации линейной.
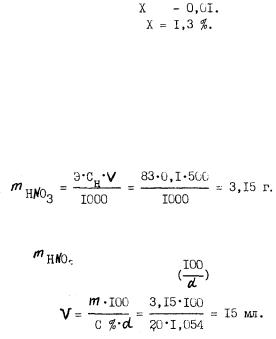
Допустим, найденная плотность равна 1,165. В табл.1 даны плот ности 1,155, что соответствует концентрации серной кислоты 22 %, и 1,178 (25 %-ная концентрация).
Находим, что в указанных пределах при изменении концентрации на 3 % плотность раствора меняется на 0,023. Наш раствор отличается от 22 %-ного по плотности на С,01.
Составляем пропорцию: 3,0 % - 0,023,
Исходный раствор содержал 22 + 1,3 = 23,3 % серной кислоты, Рассчитайте, сколько мл этой кислоты надо взять для приготов
ления 100 мл 0,1 н раствора. Пример.
Сколько мл 20 %-ной азотной кислоты нужно взять для приготов ления 500 мл 0,1 н раствора ? Плотность 20 %-ного раствора равна 1,054 г/мл.
Находим массу кислоты в 500 мл 0,1 н раствора:
Это же количество кислоты должно |
содержаться в V мл исходного |
|
20 %-ного раствора. Из пропорции |
|
|
содержится в |
V мл раствора, |
|
С %J содержится в |
мл |
раствора |
б) Требуется приготовить 100 мл 0,1 н раствора серной кислоты из имеющегося раствора серной кислоты, концентрация которого опре делена с помощью ареометра.
После определения процентной концентрации имеющегося раствора
ирасчета его объема, необходимого для приготовления 100 мл 0,1 н раствора, в мерную колбу на 100 мл налейте около 50 мл дистиллиро ванной воды, отмерьте пипеткой рассчитанный объем исходной кислоты
иперелейте его в мерную колбу. Перемешайте жидкость в колбе, ох ладите и долейте воды до метки, добавляя воду по каплям из пипетки. Тщательно перемешайте приготовленный раствор кислоты и сохраните его для опыта 2.
Опыт 2. Определение концентрации раствора кислоты методом ти трования с индикатором.
Определение нормальности и титра раствора кислоты основано на реакции нейтрализации ее раствором щелочи точно установленной кон центрации (так называемым титрованным раствором). Сам процесс на зывается титрованием.
Титрование заключается в том, что к определенному объему ис следуемого раствора приливают из бюретки титрованный раствор до полного взаимодействия. Определяют точный объем пошедшего на реак цию титрованного раствора. Реакция должна идти строго количествен но, т.е. чтобы после реакции не осталось избытка ни одного из ре агирующих веществ. Окончание реакции (точка эквивалентности) опре деляется с помощью индикаторов - веществ, которые в момент оконча ния реакции меняют свою окраску. Для разных реакций применяют раз ные индикаторы.
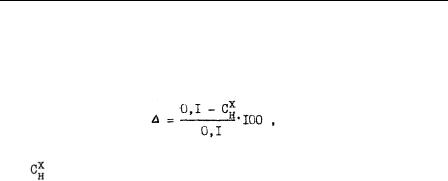
Растворы одинаковой нормальности реагируют в равных объемах (закон эквивалентов). При разных нормальностях эти растворы реаги руют между собой в объемах, обратно пропорциональных их нормальностям:
где |
и |
- нормальности кислоты и щелочи; |
и- объемы растворов кислот и щелочей.
Зная какие-либо три величины этого уравнения, легко опреде лить четвертую.
В бюретку на 25-50 мл налейте титрованный раствор щелочи Сн = 0,1. Кончик бюретки должен быть заполнен раствором. Доведите уро вень жидкости в бюретке до нуля. Отсчет следует вести по нижнему уровню мениска. Пипетку сполосните приготовленным раствором кисло ты, затем отберите ею 5 мл этого раствора, перелейте его в чистую коническую колбу для титрования (емкость 50-100 мл) и прибавьте немного воды, доведя объем раствора до 8-Ю мл. Внесите в раствор одну каплю индикатора метилового оранжевого.
Проведите ориентировочный опыт. Для этого прибавляйте из бю ретки в колбу .с кислотой по 0,5 мл щелочи, все время перемешивая жидкость вращением колбы. Конец реакции определяется по изменению окраски раствора от розового до желтого. Отсчитайте объем израсхо дованной щелочи с точностью до 0,1 мл.
Повторите титрование еще три раза, но более точно. Для этого
8 последние порции щелочи прибавляйте по каплям до тех пор, пока от
прибавления одной капли раствора щелочи не произойдет изменение окраски раствора. Объем израсходованной на титрование щелочи от считывают с точностью до 0,05 мл.
|
Перед каждым титрованием колбу для кислоты необходимо мыть и |
||||||
ополаскивать дистиллированной водой. |
|
|
|
||||
|
Из полученных данных, которые не должны различаться между со |
||||||
бой более, чем на 0,1 мл (первый замер не учитывается, |
как ориен |
||||||
тировочный), берут среднее. |
|
|
|
||||
|
Результаты опыта |
запишите в табл.2. |
|
|
|||
|
|
|
|
|
Таблица |
2 |
|
|
|
|
|
|
|||
Титрование |
|
Объем взятого |
|
Объем израс |
Среднее значе |
||
|
|
|
раствора кис |
|
ходованного |
ние объема ще |
|
|
|
|
лоты, мл |
|
раствора ще |
лочи, мл |
|
|
|
|
|
|
лочи, мл |
|
|
|
|
|
|
|
|
|
|
1-ое |
определение |
5,00 |
|
5,20 |
|
5,25 |
|
2-ое |
определение |
5,00 |
|
5,30 |
|
|
|
3-е |
определение |
5,00 |
|
5,25 |
|
|
|
Рассчитайте нормальность, титр и процентную концентрацию при готовленного раствора кислоты. Сравните нормальность приготовлен ного раствора кислоты с той, которая была задана, и определите от носительную ошибку, допущенную при приготовлении раствора.
Относительную ошибку , рассчитывают по формуле
рассчитывают по формуле
где 0,1 - заданная нормальная концентрация раствора; - нормальная концентрация раствора, найденная титрованием.
Опыт 3. Приготовление раствора заданной процентной концен трации,
Требуется приготовить 150 г 3 %-ного раствора 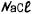 Для приготовления требуемой массы раствора заданной процент
Для приготовления требуемой массы раствора заданной процент
ной концентрации необходимо рассчитать массы растворенного вещест ва и растворителя.
Пример. Сколько г 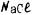 и воды требуется для приготовления I кг 7 %-ного раствора ?
и воды требуется для приготовления I кг 7 %-ного раствора ?
По определению С % в 100 г 7 %-ното раствора содержится 7 г
9
растворенного вещества. Соответственно в I кг такого раствора дол жно содержаться 70 г растворенного вещества NaCl . Так как общая масса раствора (растворителя и растворенного вещества) I кг, масса растворителя (воды) составит: 1000 г - 70 г = 930 г. Поэтому для приготовления I кг 7 %-ного раствора NaCl потребуется 70 г NaCl и 930 воды.
Рассчитайте, сколько г |
NaCl |
и |
воды необходимо для приготов |
|||
ления 150 г 3 %-ного раствора |
NaCl . |
|
|
|||
Расчетное |
число г |
NaCl |
отвесьте |
на |
лабораторных весах' с |
|
точностью 0,1 |
г. Внесите |
навеску |
NaCl |
в |
коническую колбу объемом |
|
250 мл. |
Так как при нормальных условиях (н.у.) плотность , |
α воды |
I г/мл, |
масса воды в г и ее объем в мл численно совпадают. |
Отмерь |
те мерным цилиндром объем воды, численно совпадающий с расчетной массой воды,и перелейте ее в колбу с NaCl . Раствор перемешайте до полного растворения NaCl .
Контрольные вопросы и задачи
1.Что такое раствор ? Приведите примеры жидкого, газообраз ного и твердого раствора.
2.Как измеряют плотность раствора ?
3.Какие способы выражения концентрации растворов Вы знаете ?
4.В чем сущность метода титрования ? Для чего служат индикаторы ?
5.Плотность 10 %-ного раствора NaCl 1,071 г/мл. Сколько г NaCl необходимо для приготовления I л 10 %-ного раствора ?
Сколько г |
NaCl. |
требуется .для приготовления I кг 10 %-ного раст |
|
вора NaCl |
? |
|
|
6. Вычислите |
титр, |
нормальность и молярность растворов серной |
|
кислоты следующих концентраций: |
|||
а) 34 %; в) 70 %; |
в) 96 |
% (плотности см. в табл.1). |
|
7.На титрование 10 мл 0,122 н раствора каустика пошло 12,2 мл раствора соляной кислоты. Определите нормальную концентрацию кислоты.
8.Какой объем 3,0 н раствора серной кислоты требуется для нейтрализации 8,415 г КОН ?

10
ЛАБОРАТОРНАЯ РАБОТА № 2.
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИИ
Цель работы: изучить влияние различных факторов (концентра ции, температуры, присутствия катализатора, степени измельчения) на скорость реакции.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Химическая кинетика - это учение о скорости химических реак ций и ее зависимости от внешних факторов.
Скорость химических реакций определяется изменением концен траций веществ в единицу времени:
или
средняя скорость, моль/л•с; истинная скорость, моль/л•с; концентрация вещества, моль/л;
бесконечно малое изменение концентрации; бесконечно малый промежуток времени; знак разности.
Знак (+) берется в том случае, если С - концентрация продук тов реакции; знак (-) - если скорость определяется по изменению концентрации исходных веществ.
Скорость реакции зависит от природы и концентрации реагиру ющих веществ, температуры, давления, присутствия катализатора и его свойств, степени измельчения твердой фазы, от облучения кван тами света и др. факторов.
Количественную характеристику зависимости скорости процесса от концентрации устанавливает закон действующих масс (Гульдберг и Вааге, 1867 г.): "Скорость химической реакции прямо пропорциональ на концентрации реагирующих веществ, возведенных в степени, рав ные стехиометрическим коэффициентам в уравнении реакции". Так для реакции
скорость прямого процесса
скорость обратного процесса
где К - коэффициент пропорциональности, равный скорости реакции
