
- •Опд.Ф.02 органическая химия и
- •110400 Зоотехния
- •Введение
- •Ι органическая химия ι. Общая часть
- •1.1 Теоретические основы органической химии
- •1 Углеводороды
- •1.1 Методические рекомендации
- •Общие обозначения и названия наиболее распространенных классов органических соединений, получаемых на основе углеводородов
- •1.2 Предельные углеводороды (алканы)
- •1.3 Этиленовые углеводороды (алкены)
- •1.4 Ацетиленовые углеводороды (алкины)
- •1.5 Диеновые углеводороды
- •1.6 Ароматические углеводороды (арены)
- •1.7 Вопросы для самопроверки
- •2 Галогенопроизводные углеводородов
- •2.1 Методические рекомендации
- •2.2. Вопросы для самопроверки
- •3 Спирты, фенолы
- •3.1 Методические рекомендации
- •3.2 Вопросы для самопроверки
- •4 Альдегиды и кетоны
- •4.1 Методические рекомендации
- •4.2 Вопросы для самопроверки
- •5 Карбоновые кислоты
- •5.1 Методические рекомендации
- •5.2 Вопросы для самопроверки
- •6 Углеводы
- •6.1 Простые углеводы (моносахариды)
- •6.1 Методические рекомендации
- •6.2 Сложные углеводы
- •6.3 Вопросы для самопроверки
- •7 Аминокислоты
- •7.1 Методические рекомендации
- •7.2 Вопросы для самопроверки
- •Ιι физическая и коллоидная химия
- •8 Химическая термодинамика и термохимия
- •8.1 Методические рекомендации
- •9 Растворы
- •9.1 Методические указания
- •10 Электрические свойства коллоидных систем
- •10.1 Решение типовой задачи
- •11 Задания и методические указания
- •11.1 Вопросы для выполнения домашнего задания
- •11.2 Вопросы для выполнения домашнего задания
- •Библиографический список
1.2 Предельные углеводороды (алканы)
Углеводороды с открытой цепью или ациклические углеводороды, в молекуле которых атомы углерода связаны между собой только -связями, т.е. не содержат двойных и тройных связей, носят название алканов и имеют общую формулу СnH2n+2.
Первые углеводороды их гомологического ряда получили случайные названия (исторические, тривиальные): СН4 метан; СН3СН3 этан; СН3СН2 СН3 пропан; СН3СН2СН2СН3 бутан. В основу названий следующих неразветвленных гомологов были положены греческие числительные, соответствующие числу атомов углерода, и суффикс – ан: пентан, гексан, гептан и т.д. Если от молекулы предельного углеводорода отнять атом водорода, то остаток называется алкильным радикалом R (радикалы очень активные незаряженные частицы): СН3 метил; С2Н5 этил и т.д. (см. табл. 3).
Начиная с бутана, проявляет себя скелетная изомерия:
СН3СН2СН2СН3
бутан,
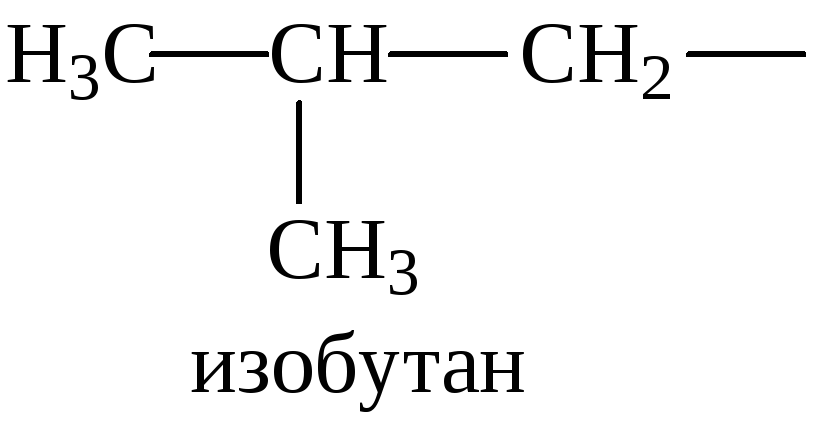
С увеличением числа атомов углерода в молекуле количество изомеров быстро возрастает, что вызывает затруднения в запоминании тривиальных названий. Тривиальные названия с приставкой «изо-» применимы для соединений, имеющих одно разветвление – две метильные группы в конце цепи:

Если атом углерода соединен с одним атомом углерода, он называется первичным (Ι), с двумя вторичным (ΙΙ), с тремя третичным (ΙΙΙ), с четырьмя четвертичным (ΙV).

Согласно номенклатуре ИЮПАК все органические вещества рассматриваются как производные построенных углеводородов. За основу выбирается самая длинная и самая сложная углеродная цепь. Нумерацию начинают с того конца, от которого ближе разветвление. Если разные алкилы находятся на равном расстоянии от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал (алкил) с меньшим числом атомов углерода. Несколько одинаковых заместителей обозначают приставками от греческих числительных: ди-, три-, тетра-, пента- и т.д. Цифрами показывается положение этих заместителей. В заключении называется нормальная углеводородная цепь:

1.3 Этиленовые углеводороды (алкены)
Углеводороды, содержащие π-связь и одну σ-связь (т.е. двойную связь), называются алкенами или этиленовыми углеводородами. Общая формула алкенов: СnH2n. Обратите внимание, что у алкенов встречаются следующие виды изомерии:
а) изомерия положения;
б) изомерия скелетная;
в) геометрическая (цис-транс) изомерия.
Запомните, что существуют две разновидности пространственной изомерии: цис- и транс-. Расположение пары одинаковых заместителей в одну сторону плоскости двойной связи дает цис-изомер, а по разные стороны транс-изомер. Если сравнить энергию образования простой и двойной связи, то можно убедиться, что одна из связей, образующих двойную, менее прочная, чем одинарная. Непрочность π-связи объясняется тем, что она имеет иное электронное строение, чем обычные σ-связи и обладает меньшей энергией образования, а поэтому и меньшей прочностью.
Следует отметить следующие способы получения алкенов:
а) дегидратация спиртов;
б) отщепление галогеноводородов от галогенпроизводных;
в) реакция дегидрирования алканов.
При изучении химических свойств этиленовых углеводородов следует обратить внимание на следующие реакции:
а) гидрирование;
б) присоединение галогенов;
в) присоединение галогеноводородов и воды по правилу Марковникова В.В.;
г) окисление (озонирование и окисление по Вагнеру);
д) полимеризации.
