
05 семестр / Лекции и семинары / Лекции
.pdf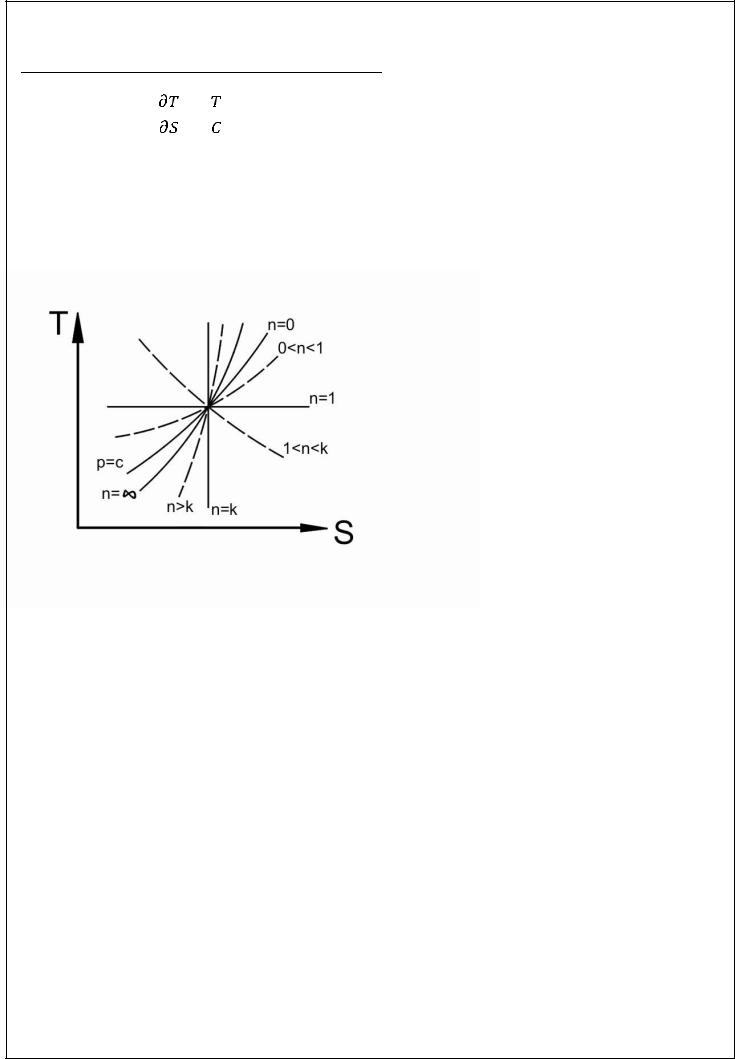
51
Расположение политропы в 
 диаграмме
диаграмме
Уклон политроп 


Очевидно, что с увеличением  уклон политроп увеличивается.
уклон политроп увеличивается.
14.5.8. Классификация политропных процессов
по характеру энергобалансов
каждый политропный процесс характеризуется своим энергобалансом. По характеру энергобалансов все политропные процессы можно разбить на три группы:
1.Процесы, идущие при расширении за счет теплоты  , сообщаемой рабочему телу извне.
, сообщаемой рабочему телу извне.

52
Схема энергобаланса
Для этой группы 

2.Процессы идущие при расширении за счет теплоты, сообщаемой рабочему телу, и изменению внутренней энергии.
Схема энергобаланса
Для этой группы 


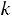
3.Процессы, происходящие за счет снижения внутренней энергии рабочего тела Схема энергобаланса

53
Для этой группы 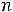
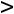
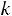
В каждой группе имеется множество процессов, которые отличаются друг от друга величинами 
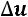
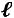 .
.
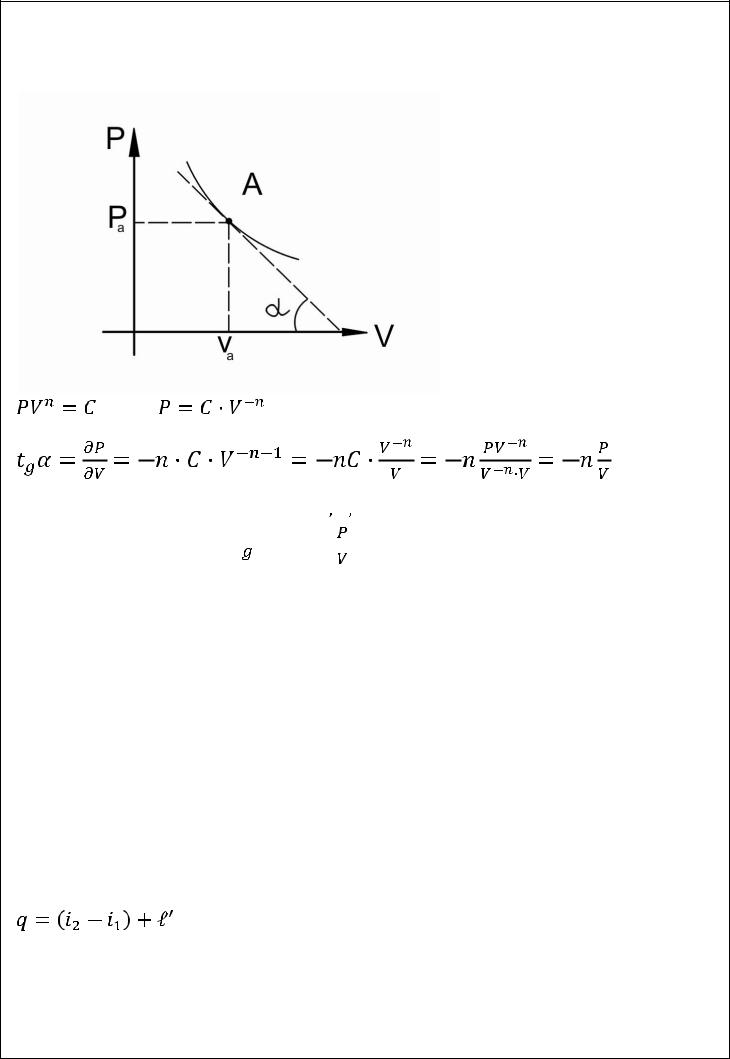
14.5.9. Определение показателя политропы n по графику в PVдиаграмме
Для 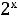 точек процесса
точек процесса 

 по масштабу измеряются параметры:
по масштабу измеряются параметры:
54
Второй способ
Так как для любой точки 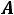 величины
величины 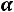

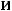
 могут быть найдены измерение то,
могут быть найдены измерение то,
следовательно, уравнение 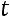
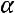


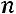
 позволяет определить величину показателя
позволяет определить величину показателя
 .
.
При процессах с переменным показателем 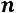 , как это бывает в реальных условиях,
, как это бывает в реальных условиях,
очевидно, что первый способ дает среднее значение показателя 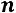 для всего процесса.
для всего процесса.
15. Определение располагаемой работы в обратимых процессах
При исседовании процессов в открытых системах в основу берут уравнение первого закона термодинамики во второй форме:
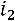

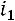
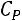
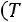
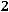

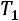
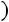
 изменение энтальпии
изменение энтальпии

 располагаемая техническая работа
располагаемая техническая работа

55
Схема энергобаланса
Установим общее состояние между  и
и 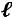 по исходному определению
по исходному определению 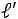

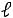

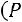
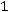
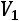


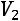
 работа проталкивания
работа проталкивания
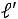
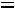



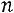
 показатель политропы Для политропного процесса
показатель политропы Для политропного процесса
Для адиабатного процесса
(для адиабаты)
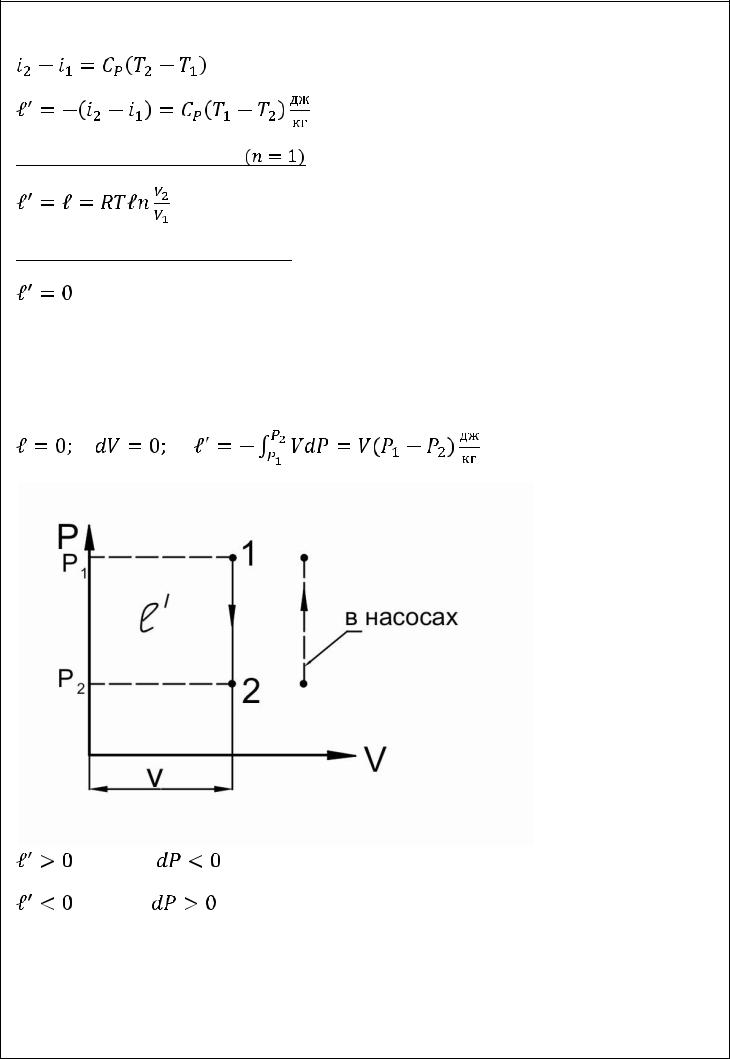
56
Для изотермного процесса
Для изобарного процесса 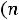
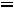

Для изохорного процесса
В насосах, гидроприводах в качестве рабочего тела используется жидкость (вода, масло и т.п.), которая практически несжимаема, поэтому:
при
при (насосы)

57
16. 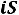
 диаграмма
диаграмма
Широко используется наряду с 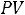
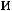

 диаграммами. Рассмотрим в iSдиаграмме основные виды обратимых термодинамических процессов.
диаграммами. Рассмотрим в iSдиаграмме основные виды обратимых термодинамических процессов.
Адиабатный процесс
Обратимая адиабата в 
 диаграмме изображается вертикальной прямой, направленной вниз при расширении и вверх при сжатии.
диаграмме изображается вертикальной прямой, направленной вниз при расширении и вверх при сжатии.

 адиабатный переход энтальпии
адиабатный переход энтальпии
это соотношение справедливо и для реальных газов и паров.
Изотермный процесс
58
Далее будет показано, что для реальных газов изотерма изображается снижающейся или повышающейся кривой
Изохорный и изобарный процессы

59
Таким образом, в 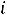

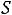
 диаграмме уклон изохоры больше уклона изобары.
диаграмме уклон изохоры больше уклона изобары.
Содержание этого раздела было посвящено исследованию обратимых процессов идеального газа, тоесть газа, подчиняющегося уравнению Клапейрона 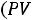
 и имеющего постоянную теплоемкость. Многие реальные газы при умеренных давлениях и достаточно высоких температурах весьма хорошо следуют уравнению Клапейрона.
и имеющего постоянную теплоемкость. Многие реальные газы при умеренных давлениях и достаточно высоких температурах весьма хорошо следуют уравнению Клапейрона.
Например, воздух и продукты сгорания топлива, используемые как рабочее вещество ряда машин и аппаратов в термическом отношении могут исследоваться с помощью приемов (аналитических и графических), разработанные в этом разделе.
Однако необходимо заметить, что в отоличие от условий идеального газа теплоемкость реальных газов непостоянна и является функцией температуры. Это зависимость существенно обнаруживается при высоких температурах. Поэтому расчетные формулы энергетических соотношений (оценка внутренней энергии, энтальпии, энтропии), установленные для идеального газа в предположении постоянной теплоемкости нуждаются в коррективах. Соответствующие теплотехнические расчеты приводятся на основе использования понятий средних теплоемкостей.
17. Итоговые формулировки  закона термодинамики
закона термодинамики
Перед изложением  закона термодинамики повторно сформулируем основные формулировки первого закона термодинамики.
закона термодинамики повторно сформулируем основные формулировки первого закона термодинамики.
1.Невозможно возникновение и уничтожение энергии
2.Любая форма движения способна и должна превращаться в любую другую форму движения
3.Внутренняя энергия является однозначной формой состояния
4.Вечный двигатель первого рода невозможен

60
5.Бесконечно малое изменение внутренней энергии является полным дифференциалом
6.Сумма количества теплоты и работы не зависит от пути процесса
Первый закон термодинамики, постулируя закон сохранения энергии для термодинамической системы не указывает на направление происходящих в природе процессов. Направление термодинамических процессов устанавливает второй закон термодинамики.
18. 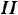 закон термодинамики
закон термодинамики
Исследование круговых процессов.
18.1. Содержание 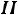 закона
закона
Второй закон, как и первый закон разрешает вопросы взаимного преобразования теплоты работы, но рассматривает этот вопрос с другой точки зрения.
В отношении тепловых машин решает две задачи:
1.Устанавливает общие условия, при которых возможно преобразование теплоты в работу.
2.Определяет степень полезного использования теплоты в тепловых двигателях, устанавливает возможный предел превращения теплоты в работу.
Заметим, что первый закон выражает собой закон сохранения энергии и не устанавливает никакого различия между энергиями (тепловой и механической, например). Все виды энергии равноценны.
Второй закон устанавливает принципиальное различие между превращениями работы в тепло и тепла в работу. Превращение 
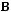
 происходит очень легко. Всю механическую работу можно превратить полностью в теплоту; превращение
происходит очень легко. Всю механическую работу можно превратить полностью в теплоту; превращение 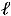

 с большими трудностями при определенных условиях, например, в тепловых двигателях никогда вся теплота
с большими трудностями при определенных условиях, например, в тепловых двигателях никогда вся теплота 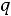 не может быть превращена в работу
не может быть превращена в работу 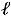 .
.
Таким образом, энергии 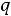
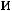
 качественно неравноценны.
качественно неравноценны.
18.2. Базисные формулировки  закона термодинамики.
закона термодинамики.
