
05 семестр / Лекции и семинары / Лекции
.pdf
21
9.3 Определение теплоемкости газовой смеси
Теплоемкость газовой смеси определяют по теплоемкости компонентов в зависимости от состава смеси :
10.Первый закон термодинамики
10.1.Определения
Наиболее общим законом всех энергопревращений является принцип сохранения энергии .Согласно этому принципу энергия изолированной системы при любых происходящих в системе процессах может переходить из одной формы в другую ,но по своей величине она остается неизменной.
Если обозначить символом Э энергию системы , то при условии полной изоляции от внешних взаимодействий для любого изменения состояния будет справедливо выражение 

 или
или 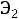


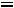
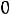
Где индекс «1» относится к начальному ,а индекс «2» относится к конечному состоянию .
Закон сохранения энергии трактуется еще в форме принципа невозможности создания вечного двигателя I рода – машины способной выполнять работу неограниченно долгое время без потребления энергии извне.
Первый закон термодинамики является частной формой общего принципа сохранения энергии , применяемой в условиях термодинамических превращений . как отмечено выше .
Термодинамические процессы предполагают две возможные формы взаимодействия с внешними системами ,а именно работу и теплоту.
В этом случае изменение энергии Э за счет взаимодействия с внешней системой , принимающей извне теплоту Q и выполняющей работу L , равно :
или
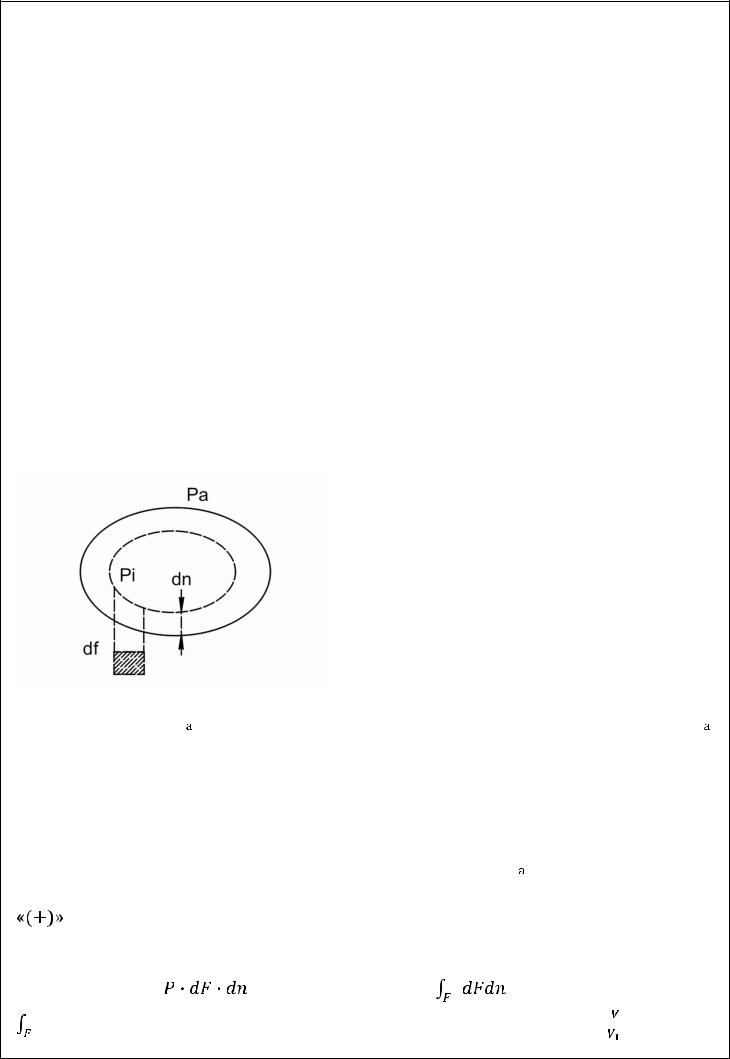
22
Это базисное уравнение первого закона термодинамики , формулирующиеся следующим образом :
Теплота Q сообщенная извне термодинамической си системе ,расходуется на изменение энергии системы Э и на выполнение работы L
Ниже рассматриваются два возможных варианта уравнения первого закона термодинамики для условий закрытой и открытой термодинамических систем.
10.2.Закрытая система .Работа процесса.
Закрытой системой называется термодинамическая система через границы которой может передаваться работа и теплота , но само рабочее вещество не пересекает границ системы .
Пример : масса газа внутри эластичной газонепроницаемой оболочки (воздушный шар с газовой горелкой внутри)
В условиях закрытой системы работа газа определяется исключительно изменением его объема ,т.е по существу они являются работой деформации тела
Вообразим что 1 кг газа в условиях закрытой системы при внутреннем давлении  и объеме V расширяется , преодолевая силы
и объеме V расширяется , преодолевая силы
внешнего давления  .Если внутреннее давление
.Если внутреннее давление 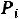 превышает внешнее давление
превышает внешнее давление 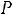 лишь на бесконечно малую величину , то процесс расширения будет протекать очень медленно , без внутреобразования внутри самого газа , избегая явлений необратимости ; обратимость процесс расширения, обеспечивает максимум выполняемой работы .
лишь на бесконечно малую величину , то процесс расширения будет протекать очень медленно , без внутреобразования внутри самого газа , избегая явлений необратимости ; обратимость процесс расширения, обеспечивает максимум выполняемой работы .
В целях упрощения последующего обсуждения примем 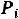



 при сжатии затрачивается работа из вне и она со знаком
при сжатии затрачивается работа из вне и она со знаком 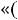

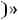 , при расширении – со знаком
, при расширении – со знаком
При бесконечно малом изменении на каждом элементарном участке  газ
газ
совершает работу |
,но всей поверхности P |
,но поскольку |

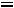
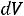 , то
, то 

 ,для конечного обратимого процесса
,для конечного обратимого процесса 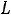

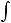

23
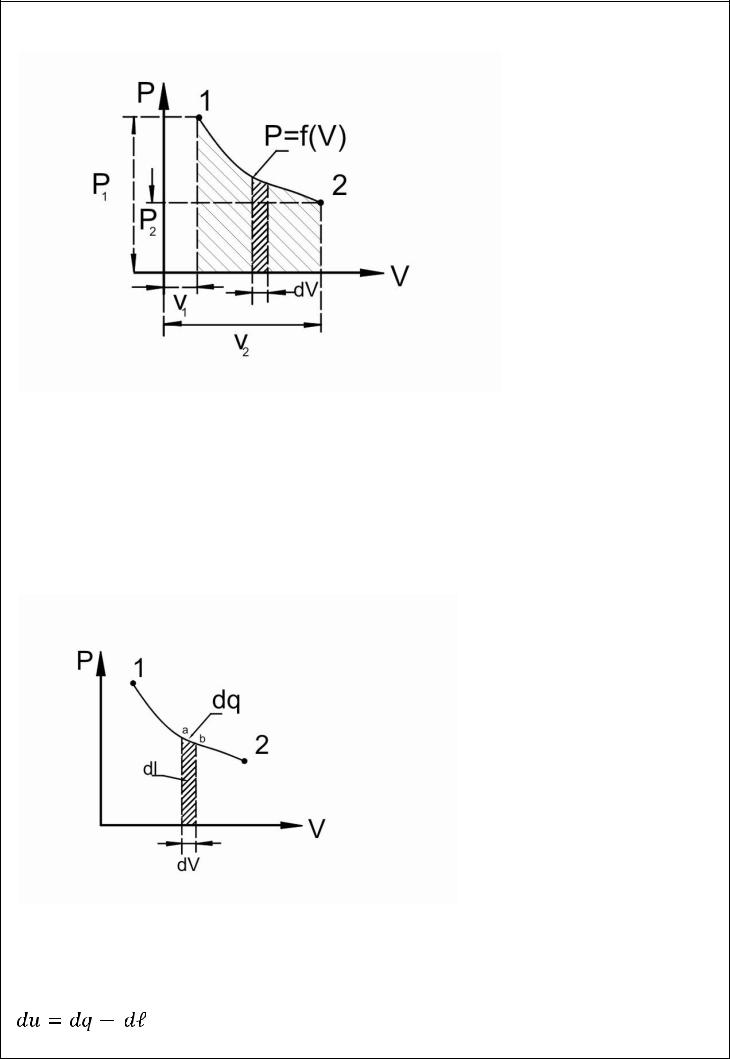
Рассмотрим работу изменения объема в случае движения поршня в цилиндре.
Процесс расширения газа также идет с бесконечно малой скоростью , т.е является обратимым процессом обратимые процессы изображаются графически в PVдиаграмме
24
Величина работы расширения зависит от характера процесса .Работа обратимого процесса сжатия вычисляется по этой же формуле
При расширении 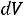


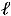

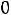
При сжатии 
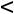

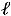

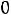
10.3 Математическое выражение I закона термодинамики для закрытой системы

 подведенное тепло
подведенное тепло
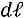
 элементарная работа расширения
элементарная работа расширения

25
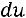
 изменение внутренней энергии в элементарном процессе.
изменение внутренней энергии в элементарном процессе.
После интегрирования получим
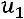 и
и 
 внутренняя энергия в начальном и конечном состоянии.
внутренняя энергия в начальном и конечном состоянии.
изменение внутренней энергии.
Математическое выражение первого закона термодинамики для закрытой системы гласит:
Теплота  , сообщающаяся из вне, в результате термодинамического процесса расходуется на изменение внутренней энергии
, сообщающаяся из вне, в результате термодинамического процесса расходуется на изменение внутренней энергии 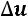 на совершение работы расширения
на совершение работы расширения  .
.
При обратных процессах:
10.4. Внутренняя энергия рабочего вещества.
Внутренняя энергияэто энергия внутреннего состояния тела. Состоит из термической энергии, химической, ядерной энергии.
В технической термодинамике рассматриваем только термическую энергию, которая представляет собой энергию движения и взаимодействия молекул и атомов вещества.
Для реальных газов
, где
внутренняя кинетическая энергия молекул

26
Зависит только от температура, т.е.

 внутренняя потенциальная энергия, обусловленная взаимодействием молекул
внутренняя потенциальная энергия, обусловленная взаимодействием молекул
Внутренняя энергия является функцией состояния. Определяется любыми двумя параметрами состояния.
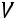


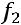

 =
=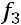
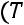

Принимается, что 

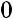 при
при 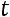




Изменение внутренней энергии определяется начальным и конечным состоянием и не зависит от пути (характера) процесса.
Определение изменения внутренней энергии
Пусть 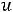


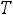

 В дифференциальной форме имеем:
В дифференциальной форме имеем:
Смысл 

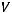 :
: 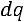
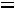
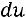

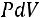

27
Так как 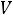



следовательно
и 

Наиболее просто логично определить 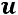 для идеальных газов, когда кинетическая энергия молекул зависит лишь от температуры:
для идеальных газов, когда кинетическая энергия молекул зависит лишь от температуры:
тогда
Соответственно, внутренней энергии 1кг идеального газа, равно:

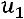






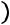
 при
при 


При 

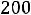

 нужно учитывать, что
нужно учитывать, что 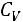
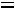
При изменении температуры от 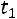 до
до 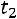
Так как 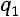



 то по величине
то по величине  можно вычислить количество теплоты
можно вычислить количество теплоты
Для реального газа величина 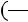



10.5. Открытая термодинамическая система
Располагаемая техническая работа
Открытая термодинамическая система, через границы которой кроме теплоты и работы может проходить само рабочее тело. Эта система устанавливаемого потока рабочего тела.
Открытая система соответствует условиям работы тепловых машин и аппаратов.

28
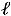



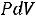
 работа изменения объема для закрытой системы
работа изменения объема для закрытой системы
Открытая система расширена и состоит из рабочего тела и окружающей среды.
Работа термодинамического процесса в открытой системе для устанавливаемого потока называется располагаемой технической работой 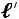
Для определения 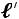 1кг массы рабочего тела рассмотрим прохождение рабочего тела через идеальную тепловую машину
1кг массы рабочего тела рассмотрим прохождение рабочего тела через идеальную тепловую машину
скорости потока, 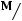

Точка 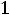
 отличает состояние рабочего тела при входе в мшину;
отличает состояние рабочего тела при входе в мшину;
Точка 
 при выходе из машины.
при выходе из машины.
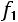


 площади входного и выходного патрубков,
площади входного и выходного патрубков, 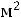
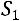
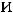

 перемещения массы газа, м.
перемещения массы газа, м.
При входе рабочее тело выполняет работу наполнения:

29
Процесс входа механический процесс
В процессе 

 выполняется работа изменения объема:
выполняется работа изменения объема:
Затем рабочее тело удаляется из машины. На это затрачивается работа
В итоге работа  равна алгебраичной сумме работы, изменения объема и работы проталкивания рабочего тела через машину:
равна алгебраичной сумме работы, изменения объема и работы проталкивания рабочего тела через машину:
|
|
|
|
|
|
|
|
|
|
|
|
площадь |
||||
|
|
|
|
|
|
|
|
|||||||||
При распирании |
|
|
|
|
|
|
|
|
положительна |
|||||||
|
|
|
|
|
|
|
|
|||||||||
При сжатии |
|
|
|
|
|
|
отрицательна |
|||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
10.6. Энтальпия газа |
|||
Энтальпия газа |
|
функция состояния, которая используется для оценки термической |
||||||||||||||
|
||||||||||||||||
энергии в открытой системе, в условиях потока |
||||||||||||||||
Обозначения: |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
для 1кг |
|
|
|
|
для 6кг |
||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
кдж |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для 1кг массы вещества
Энтальпия  представляет собой термическую энергию рабочего тела в данном
представляет собой термическую энергию рабочего тела в данном
состоянии и равна сумме его внутренней энергии 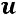 и потенциальной энергии
и потенциальной энергии

30
давления 

 , она представляет собой энергию, обусловленную статическим напором, под которым находится рабочее тело в открытой системе.
, она представляет собой энергию, обусловленную статическим напором, под которым находится рабочее тело в открытой системе.
Произведение 

 численно равно работе заполнения работе, которую нужно затратить для получения рабочего тела объемом
численно равно работе заполнения работе, которую нужно затратить для получения рабочего тела объемом 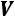 в среду с давлением
в среду с давлением 
Энтальпия является функцией состояния, определяется двумя любыми параметрами состояния:
Для 6кг
В технических расчетах используется 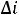
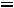


 , при этом
, при этом 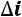 определяется начальным и конечным состоянием работы тела и не зависит от характера (пути) процесса, т.е.:
определяется начальным и конечным состоянием работы тела и не зависит от характера (пути) процесса, т.е.:
10.7. Математическое выражение T закона термодинамики
для открытой системы
для закрытой системы
В открытых системах такое дифференциальное уравнение не отвечает содеражанию процесса полностью
где 
 работа проталкивания
работа проталкивания
Математическое выражение первого закона термодинамики для открытой системы имеет вид:
Для тепловых машин это выражение предпочтительнее.
Для обратных процессов
