
05 семестр / Лекции и семинары / Лекции
.pdf
91
трубке равно нулю, скрытой тепло  равно нулю), и при которой жидкость, несмотря на никакое давление и объем вся превращается в пар».
равно нулю), и при которой жидкость, несмотря на никакое давление и объем вся превращается в пар».
При 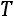
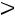
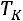 сжижение газа невозможно, но определим значения
сжижение газа невозможно, но определим значения 
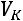
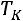

В точке 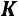 изотермы имеют перегиб
изотермы имеют перегиб
Совместно решая эти уравнения, определяем:
Значения 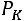
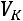

 приближенные для реальных веществ. Поэтому точные параметры критической точки различных веществ определяют экспериментальным путем.
приближенные для реальных веществ. Поэтому точные параметры критической точки различных веществ определяют экспериментальным путем.
19.3. Фазовые переходы. Правило фаз Гиббса
Существуют два вида фазовых переходов первого и второго рода. Фазовые переходы первого рода связаны с кипением, плавлением. Кристаллизацией, конденсацией и сопровождаются скачкообразным изменением внутренней энергии и объема (поглощением или выделением скрытого тепла перехода).
Фазовые переходы первого уровня характеризуются большим возрастанием теплоемкости в очень узкой области вокруг точки перехода. Физическая природа
92
этого состоит в том, что добавление теплоты к системе в точке фазового перехода не повышает температуру системы, а расходуется на перестройку системы.
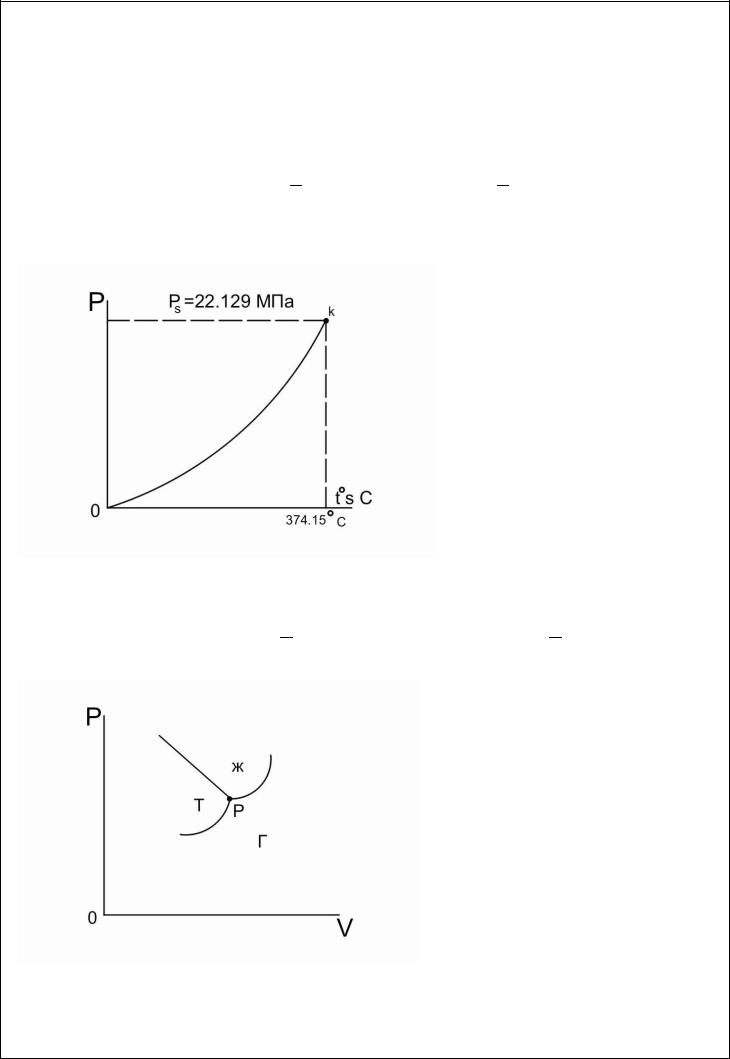
Зависимость между давлением насыщенного пара  и температурой кипения
и температурой кипения 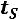 устанавливают опытным путем. На рисунке представлена эта зависимость для водяного пара. Точки этой кривой кривые равновесия фаз представляют те состояния, в которых пар и жидкость или, иначе , жидкость и газообразные фазы,
устанавливают опытным путем. На рисунке представлена эта зависимость для водяного пара. Точки этой кривой кривые равновесия фаз представляют те состояния, в которых пар и жидкость или, иначе , жидкость и газообразные фазы,
находятся в устойчивом термодинамическом равновесии.
Все точки, не лежащие на кривой равновесия фаз, соответствуют отдельным фазам. В данном случае точки над кривой жидкая фаза, точки под кривой газообразная фаза. Кривая равновесия жидкой и газообразной фаз заканчивается в критической
точке 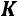 .
.

93
Кривая равновесия жидкой и газообразной фаз начинается в точке  . Точка
. Точка  называется тройной точкой (для воды
называется тройной точкой (для воды 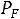
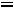
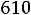
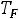


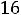
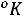
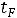
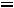
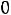
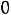
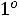
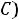
В этой точке сосуществуют и находятся в термодинамическом равновесии три фазы вещества (твердая
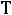 жидкая
жидкая
 газообразная
газообразная
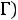
 на рисунке представлена фазовая диаграмма относительно тройной точки
на рисунке представлена фазовая диаграмма относительно тройной точки  .
.
По правилу фаз, данному Д.Гиббсом:
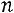
 число компонентов, т.е. число химически различных веществ, входящих в смесь;
число компонентов, т.е. число химически различных веществ, входящих в смесь;
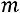
 число фаз;
число фаз;

 число степеней свободы или, иначе, число независимых термодинамических параметров, определяющих состояние рабочего тела.
число степеней свободы или, иначе, число независимых термодинамических параметров, определяющих состояние рабочего тела.
Для однокомпонентной жидкости или паров той же жидкости число компонентов


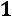 . Тогда
. Тогда 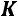
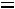
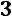

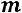 . Для однофазной системы (взятых в отдельности пар или жидкость)
. Для однофазной системы (взятых в отдельности пар или жидкость) 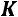
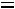
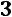


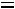
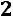 т.е. число независимых переменных, определяющих состояние равно двум, при одном и том же давлении жидкость или газ может находится при различных температурах (например, область перегретого пара однофазная система, определяется двумя параметрами
т.е. число независимых переменных, определяющих состояние равно двум, при одном и том же давлении жидкость или газ может находится при различных температурах (например, область перегретого пара однофазная система, определяется двумя параметрами
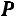 и
и 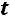 )
)
Для двухфазной системы 
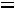
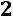 и
и 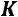


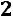

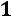 . Следовательно, для любой двухфазной системы заданному давлению соответствует только одна, строго определенная температура (область влажного пара
. Следовательно, для любой двухфазной системы заданному давлению соответствует только одна, строго определенная температура (область влажного пара 
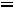
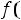
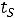
Понятие о фазовых переходах второго рода было установлено в 1933г Эренфестом. Под этими переходами принято понимать процессы, не сопровождающиеся теплообменом с окружающей средой и изменением объема, но у которых скачкообразно меняется :теплоемкость 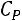

Коэффициент изобарного расширения 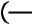
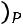

Коэффициент изобарного сжатия 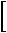

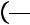
Эти переходы не сопровождаются изменением агрегатного состояния и происходят в пределах определенной фазы. Механизм их состоит в перегруппировке атомов и молекул вещества.
94
Типичным примером фазового перехода второго рода является переход при 
 и атмосферном давлении одной жидкой фазы имея
и атмосферном давлении одной жидкой фазы имея  в другую жидкую же фазу
в другую жидкую же фазу 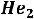 в которой исчезает вязкость . в связи с этим
в которой исчезает вязкость . в связи с этим 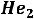 становится сверхтекучим. Другим примером фазового перехода второго рода могут служить явления, происходящие в некоторых металлах (в твердой фазе), когда они из обычного состояния переходят в состояние, в котором исчезает электрическое сопротивление и они становятся сверхпроводящими.
становится сверхтекучим. Другим примером фазового перехода второго рода могут служить явления, происходящие в некоторых металлах (в твердой фазе), когда они из обычного состояния переходят в состояние, в котором исчезает электрическое сопротивление и они становятся сверхпроводящими.
19.4. Уравнение Клапейрона Клаузиуса
Фазовые переходы первого рода сопровождаются теплообменом с внешней средой и изменением объема.
Уравнение Клапейрона Клаузиуса выражает зависимость между теплотой
парообразования 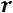 и параметрами состояния (
и параметрами состояния (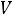
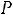
 ).
).
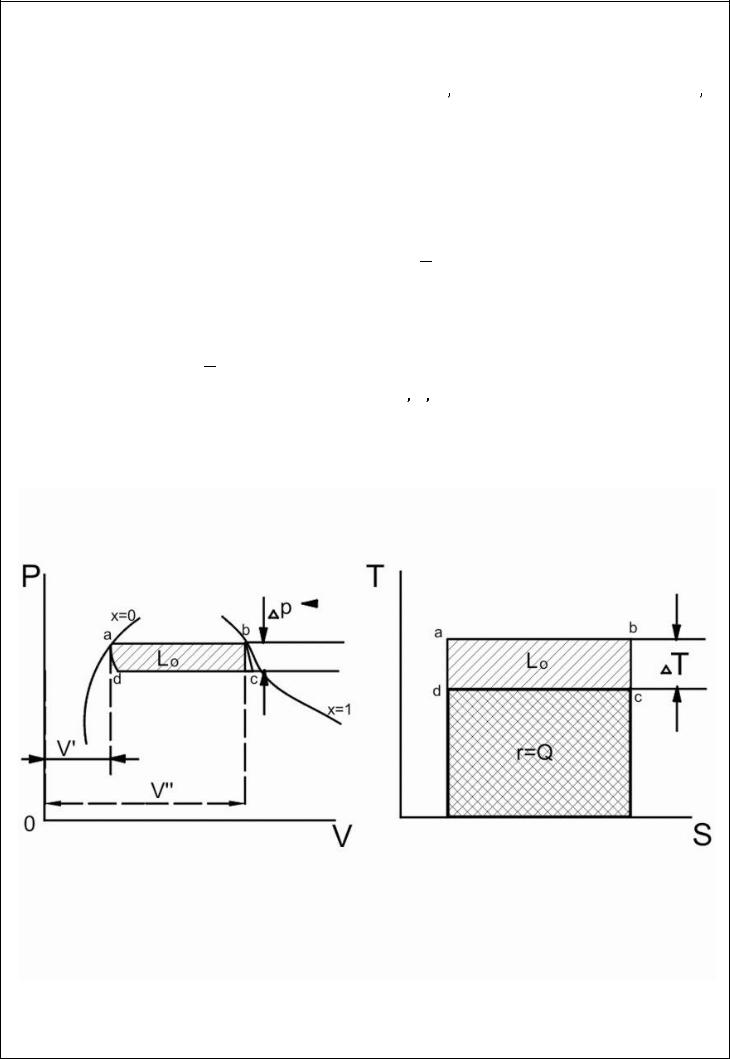
Для обоснования этого уравнения рассмотрим обратимый двигатель Карно, действующий сухим насыщенным паром

 степень сухости
степень сухости

95
или |
|
или |
|
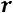
 теплота парообразования
теплота парообразования
С другой стороны (см.рисунок)
где
и 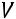
 идеальные объемы кипящей жидкости и кипящего пара.
идеальные объемы кипящей жидкости и кипящего пара.
Для бесконечно малой разности давления, когда 

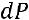 и
и 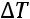

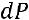 имеем:
имеем:
окончательно:
Это уравнение КлапейронаКлаузиуса имеет большое значение в экспериментальной термодинамике, поскольку в нем дана математическая зависимость между теплотой парообразования 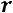 , изменением объема вещества при парообразовании
, изменением объема вещества при парообразовании 



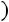
и наклоном кривой упругости насыщенного пара 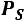

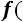
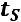
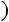 т.е.
т.е.
19.5. Свойства водяного пара
Водяной паргаз, близкий к состоянию сжижения. Уравнение состояния идеального газа совершенно неприемлимо к водяному пару.
Для реальных газов в общем виде:
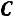
 коэффициент сжатия, может быть
коэффициент сжатия, может быть 
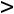
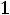 или
или 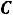
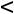
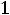
Уравнение состояния, описывающее приближенно свойства водяного пара БогомоловаМайера имеет вид:
вириальные коэффициенты

96

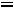

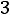
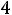



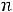
 порядковый номер вириального коэффициента
порядковый номер вириального коэффициента
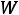
 уделяемый объем
уделяемый объем
Кроме объема молекул и сил сцепления надо учитывать явление ассоциации объединение молекул в двойные и тройные комплекты. Величины
параметров состояния водяного пара устанавливаются исключительно опытным путем и даются в виде численных таблиц или численных диаграмм. Это объясняется тем, что в настоящее время основным рабочим телом при выработке электрической и тепловой энергии в мире является водяной пар.
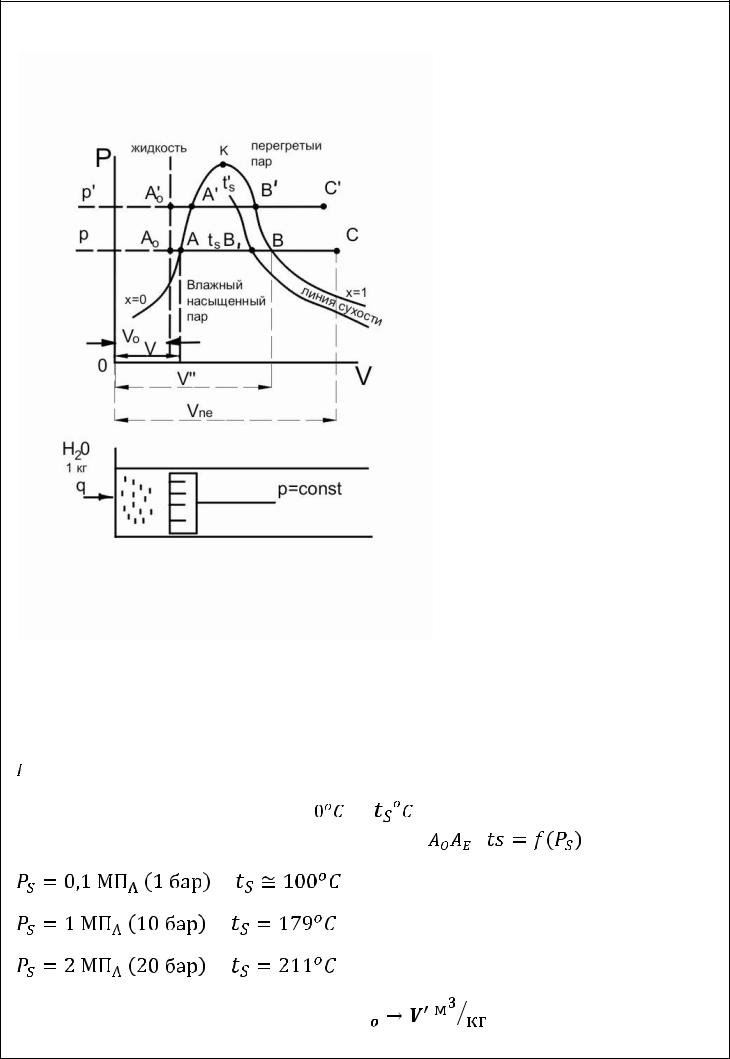
Процесс получения пара при 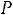
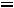
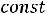
В технике пар получают в специальных конструкциях, которые называются котельными агрегатами или парогенераторами. Давление меняется от 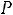


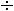
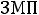
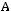 до
до 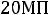
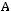 и выше.
и выше.
Рассмотрим процесс получения пара в 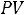
 диаграмме
диаграмме
97
Давление под поршнем постоянно (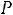
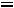
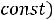
Точка 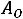


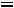
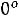
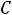
 вода
вода
19.6. Три стадии процесса парообразования
стадия. |
|
|
|
|
|
|
Происходит нагревание жидкости от |
до |
|
температуры кипения (до |
|||
|
||||||
образования первого пузырька пара). Этопроцесс |
|
|
||||
|
|
|
|
|
|
|
При нагревании жидкость расширяется от 

98
Точка 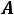
 состояние кипящей воды
состояние кипящей воды
Теплота на нагрев жидкости:
 стадия.
стадия.
С точки начинается процесс парообразования |
|
процесс |
. При этом |
, |
|
Пар, выделяющийся из кипящей жидкости имеет 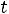
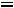
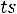 и называется насыщенным паром.
и называется насыщенным паром.
В точке 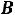
 сухой насыщенный пар
сухой насыщенный пар
Теплота парообразования 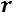 , затрачиваемая на превращение воды при температуре насыщения в сухой насыщенный пар.
, затрачиваемая на превращение воды при температуре насыщения в сухой насыщенный пар.
где
внешняя теплота испарения;
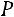

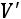
 внешняя теплота испарения
внешняя теплота испарения

 внутренняя теплота испарения, расходуемая на дисгрегацию жидкости (уменьшение сил сцепления между молекулами жидкости)
внутренняя теплота испарения, расходуемая на дисгрегацию жидкости (уменьшение сил сцепления между молекулами жидкости)
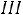 стадия
стадия
Процесс ABперегрев пара. Пар, температура которого больше 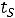
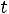
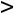
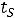 называется перегретым паром.
называется перегретым паром.
При перегреве удельный объем увеличивается 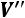
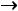
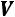
Теплота, затрачиваемая на перегрев
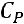
 средняя теплоемкость от
средняя теплоемкость от 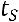 до
до 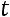

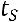

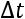
 степень перегрева
степень перегрева

99
Аналогично процесс можно провести при любом другом давлении 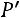
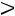
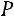
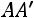
 нижняя пограничная кривая
нижняя пограничная кривая 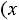
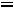
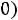
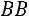

 верхняя пограничная кривая
верхняя пограничная кривая 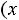
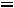
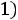
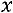
 степень сухости пара
степень сухости пара 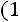

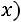
 влажность пара
влажность пара 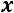 изменяется от
изменяется от 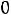
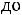
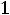
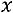
 100% капельной жидкости
100% капельной жидкости
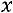
 сухой насыщенный пар
сухой насыщенный пар
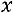
 влажный насыщенный пар (5%- массы жидкости)
влажный насыщенный пар (5%- массы жидкости)
По мере повышения давления пограничные точки сближаются. Точка 
 критическая точка водяного пара:
критическая точка водяного пара:
19.7. Определение параметров насыщенного пара и кипящей воды
Насыщенным паром называется пар, выделяющийся из кипящей жидкости, имеющей температуру 



Основное свойство насыщенного пара в том, что его давление зависит лишь от температуры насыщения  и для данной температуры остается постоянным. Между кипящей жидкостью и паром существует тепловое динамическое равновесие:
и для данной температуры остается постоянным. Между кипящей жидкостью и паром существует тепловое динамическое равновесие:
По физическому состоянию насыщенный пар может быть сухим и влажным.
Сухой насыщенный пар не содержит в своем объеме капелек жидкости. Параметры сухого насыщенного пара определяются одним параметром: либо  либо
либо 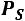 .
.
Параметры определяются по таблице сухого насыщенного пара: 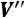

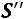


Влажный насыщенный пар пар, содержащий в своем объеме мелкие капельки жидкости 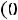
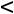
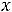



100
Влажный насыщенный пар определяется двумя параметрами: 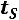 и
и 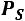 и степенью сухости
и степенью сухости

При 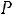
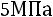
19.8. Определение параметров перегретого пара
Перегретый пар |
|
пар, температура которого |
Параметры перегретого пара |
|
|||
определяются двумя независимыми температурами: |
и |
||
По своим свойствам перегретый пар приближается к газам, но реальным газам. Параметры перегретого пара определяются таблицами и диаграммами.
19.9. Энтальпия воды и водяного пара
При технических инженерных расчетах с водяным паром тепловые характеристики выражают через энтальпии.
Энтальпия выражает собой термическую энергию равной сумме внутренней энергии 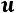 и потенциальной энергии давления
и потенциальной энергии давления 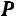

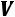
В соответствии с первым законом термодинамики:
Для получения пара при |
|
следовательно |
|
|
|
|
|
|
При получении пара энтальпия 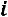 возрастает на величину сообщенной теплоты в каждой стадии процесса. Рассмотрим процесс получения пара по стадиям.
возрастает на величину сообщенной теплоты в каждой стадии процесса. Рассмотрим процесс получения пара по стадиям.
