
05 семестр / Лекции и семинары / Лекции
.pdf
11
В этом случае недостающий параметр определяются аналитически. Например
 )
)
Уравнения состояния идеального газа
Идеальный газ – газ , в котором силы взаимодействия молекул равны нулю,а сами молекулы являются материальными точками ,т.е имеющими массу , но не имеющие объема .
Реальные газы – газы ,где действуют силы взаимодействия , а молекулы имеют объем
.Реальные газы при определенных условиях приближаются к идеальным газам .

12
Уравнение состояние идеального газа ,называется уравнение Клайперона имеет вид:
; T °K
R – газовая постоянная данного газа
R-численно равна работе расширения 1 кг газа при нагревании его на 1 °K при постоянном давлении (P=const)
Если вместо удельного объема Ѵ |
|
подставить отношение |
|
,в таком |
|
|
|||
случае имеем : |
|
|
|
|
Уравнение состояния для одного моля идеального газа
Киломолем или килограмм-молекулой называется количество вещества по массе в килограммах , численно равное молекулярному весу µ данного вещества
На основании закона Авогадро известно , что при равных давлениях и температурах объем одного моля для всех газов одинаков ,т.е
Например, при нормальных условиях 



 (760 мм.рт.ст.) и
(760 мм.рт.ст.) и
температуре |
плотность азота |
|
,тогда |
|




 , т.е при нормальных условиях объем моля любого
, т.е при нормальных условиях объем моля любого
газа равен:
Реальные газы в ряде случаев отклоняются от числа 22,4 ,например :

13
Для 


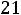



Для 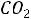






Для 1 моля газа уравнение примет вид
При нормальных условиях : 101325







Уравнение состояния для 1 моля идеального газа имеет вид
Величина  называется универсальной газовой постоянной или постоянной Менделеева а уравнение называется уравнением Клайперона-Менделеева
называется универсальной газовой постоянной или постоянной Менделеева а уравнение называется уравнением Клайперона-Менделеева
Газовая постоянная для любого газа равна
Уравнения состояния идеального газа с допустимой погрешностью используется в расчетах для реальных газов в состоянии близких к сжижению . Для них используется уравнения состояния для реальных газов.
В общем случае уравнение состояния для реальных газов имеет вид :
C – коэффициент сжатия
Коэффициент C может быть больше и меньше нуля (С>0 или C<0)
Повышение давления ,понижение температуры ,увеличение концентрации молекул , где устанавливают отклонения свойств реального газа от идеального.

14
7.Газовые смеси
В качестве рабочих тел используют газовые смеси – воздух 


 ; продукты сгорания топлива (
; продукты сгорания топлива (



 …); горючие газы (природный газ , светильный газ и т.д )
…); горючие газы (природный газ , светильный газ и т.д )
Исходным законом для определения свойств смеси газа является закон Дальтона : в газовой смеси каждый компонент проявляет себя так , как если бы другие компоненты отсуществовали ,т.е каждый газ ,входящий в смесь находиться при своем парциальном давлении и занимает весь объем смеси.
Общее давление смеси равно сумме парциальных компонентов
Определение молекулярной массы смеси
При равномерном перемешивании смесь можно считать однородной средой.
Молекулярная масса смеси |
определяется по количественному составу смеси |
Количественный состав газовой смеси задается :
Числом молей компонентов 


Объемными долями компонентов 


Массовыми долями компонентов 


В рабочих условиях камеры сгорания топки котла , газовый турбины газовым анализатором экспериментально устанавливается состав продуктов сгорания топлива объемными долями ; при проектировании теплосиловых установок состав газовой смеси устанавливается расчетом по массе и по молям .
Объемные доли 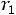

 определяются отношениями приведенных объемов компонентов
определяются отношениями приведенных объемов компонентов 

 к общему объему смеси
к общему объему смеси
Массовые доли 

 определяются отношениями масс компонентов
определяются отношениями масс компонентов 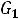

 к общей массе газовой смеси G
к общей массе газовой смеси G
Состав смеси , заданный числом молей компонентов 



15
Известны : 

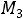
Средняя молекулярная масса смеси равна сумме масс компонентов
Состав смеси задан по объему :

 - общий объем смеси
- общий объем смеси


 -парциальные объемы компонентов приведенные к объему давления смеси P
-парциальные объемы компонентов приведенные к объему давления смеси P
Относительный состав смеси задается объемными долями
Если r в процентах ,то 


 Соотношения между r и M :
Соотношения между r и M :
Состав смеси задан по массе компонентов
Массовые доли компонентов смеси :

16
Соотношение между q и r
В реальных условиях измеряется общее давление газовой смеси .Величины парциальных давлений могут быть вычислены если известен количественный состав смеси.
Если заданы объемные доли :
Если заданы мольные доли :

17
Если заданы массовые доли :
8.Уравнение состояния в дифференциальной форме
Уравнение состояния в общем виде
Для любого вещества может быть представлена в дифференциальной форме
Для условий 

 и
и 

 имеем :
имеем :
В окончательной форме :

 -термическая упругость вещества
-термическая упругость вещества

18
–термическая расширяемость вещества


 -термическая сжимаемость вещества
-термическая сжимаемость вещества
9.Теплоемкость газов
9.1 Основные виды теплоемкостей газов
Теплоемкость измеряется количеством теплоты , необходимой для нагревания единицы вещества на один градус в данном процессе .
Различают следующие виды теплоемкостей :
Массовая теплоемкость 

Объемная теплоемкость 

Мольная теплоемкость 

Теплоемкость зависит от физических свойств газа , от его атомности.
Мольная теплоемкость газа увеличивается с увеличением атомности газов
Теплоемкость зависит от параметров состояния газа (Т,Р) . Для идеальных газов по существу теплоемкость зависит только от Т.
Теплоемкость газа зависит так же от характера процесса(так как теплота является функцией процесса).Теплоемкость является свойством вещества газа , если она относиться к определенному фиксированному процессу . В качестве основных теплоемкостей приняты для газовых процессов :
Все эти виды теплоемкостей даны в справочниках
Соотношения между основными видами теплоемкостей для идеального газа

19


 - уравнение Майера
- уравнение Майера
9.2.Зависимость теплоемкости газов от температуры Т . Истинная средняя теплоемкость
Теплоемкость газов с увеличением температуры повышается (так как устанавливается колебательное движения атомов и молекул)
Теплоемкость ,взятая при данной температуре t называется истинной теплоемкостью
Функция 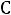


 представляется многочленом тела
представляется многочленом тела

20
В технических расчетах не используется истинная теплоемкость . Вводится понятие средней теплоемкости , некоторой константе в данном интервале температур 
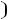

Числовые величины  для интервалов температур
для интервалов температур 




 для всех видов газов подсчитаны и сведены в таблицу (по конечной температуре)
для всех видов газов подсчитаны и сведены в таблицу (по конечной температуре)
Тепловые потоки рассчитываются по соотношениям :
В интервале температур 




 :
:
, 
Или |
средние табличные теплоемкости |

 - индекс среднего значения(«middle»)
- индекс среднего значения(«middle»)
Наряду с таблицами имеются и формулы для определения средних теплоемкостей
Например
Для воздуха в интервале температур 


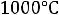
Средняя мольная теплоемкость при |
: |
При температуре газов меньше 200°С зависимость теплоемкостей от температуры можно не учитывать
