
- •Министерство образования и науки Российской Федерации
- •Иркутский государственный технический университет
- •Оглавление
- •Лекция № 1. Основные понятия и законы химии
- •Основные понятия
- •Основные законы
- •Лекция № 2. Строение атома
- •Строение электронной оболочки
- •Лекция № 3. Электронная конфигурация атома
- •Лекция № 4. Периодический закон и периодическая система элементов
- •Лекция № 5. Химическая связь. Строение вещества
- •Лекция № 8. Скорость химической реакции
- •Факторы, влияющие на скорость химических реакций.
- •Лекция № 9. Химическое равновесие
- •Факторы, влияющие на смещение равновесия
- •Лекция № 10. Растворы. Концентрация растворов. Основы физической теории растворов
- •Концентрация растворов
- •Основы физической теории растворов
- •Лекция № 11. Теория электролитической диссоциации
- •Теория электролитической диссоциации
- •Реакции ионного обмена
- •Теория кислот и оснований
- •Лекция № 12. Гидролиз солей
- •Лекция № 13. Дисперсные системы
- •Лекция № 11. Окислительно-восстановительные реакции
- •Классификация окислительно-восстановительных реакций
- •Составление уравнений окислительно-восстановительных реакций
- •Лекция № 15. Электрохимические системы электроды
- •Ряд напряжений характеризует химические свойства металлов:
- •Гальванические элементы
- •Электролиз
- •Катодный процесс
- •Анодный процесс
- •2. При электролизе различных химических соединений равные количества приводят к электрохимическому превращению эквивалентных количеств веществ.
- •Коррозия металлов
- •Лекция № 16. Полимеры
- •Лекция № 17. Химическая идентификация
- •Библиографический список
Реакции ионного обмена
Реакции между ионами, образовавшимися в результате диссоциации электролитов, называются реакциями ионного обмена.
Правила составления ионных уравнений реакций
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют и на ионы не расписываются.
2. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Порядок составления ионных уравнений реакции
1. Записывают молекулярное уравнение реакции:
MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости:
p p н p
MgCl2 + 2AgNO3 = 2AgCl↓ + Mg(NO3)2
3. Записывают полное ионное уравнение реакции
Mg2+ + 2Clˉ + 2Ag+ + 2NO3ˉ = 2AgCl↓ + Mg2+ + 2NO3ˉ
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg2+
+ 2Clˉ + 2Ag+
+ 2NO3ˉ
= 2AgCl↓ + Mg2+
+
2NO3ˉ
Ag+ + Clˉ = AgCl↓
Условия необратимости реакций ионного обмена
1. Если образуется осадок (↓):
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
Pb2+ + 2Iˉ = PbI2↓
2. Если выделяется газ (↑):
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑
3. Если образуется малодиссоциированное вещество (H2O):
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
H+ + OHˉ = H2O
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O), реакции обмена обратимы.
Теория кислот и оснований
На основании теории электролитической диссоциации Аррениус дал новые определения основаниям, кислотам и солям.
Кислоты – это электролиты, диссоциирующие с образованием катионов водорода Н+:
HNO3 = H+ + NO3ˉ
Диссоциация многоосновных кислот протекает по ступеням:
H3PO4 = H+ + H2PO4ˉ I ступень
H2PO4ˉ = H+ + HPO42ˉ II ступень
HPO42ˉ = H+ + PO43ˉ III ступень
Основания – это электролиты, диссоциирующие с образованием гидроксид-ионов ОНˉ:
NaOH = Na+ + OHˉ
Если основание содержит в молекуле несколько гидроксильных групп, то диссоциация будет происходить ступенчато:
Сa(OH)2 =СаОН+ + OHˉ I ступень
СaOH+ =Сa2+ + OHˉ II ступень
Уравнение полной диссоциации имеет следующий вид:
Сa(OH)2 = Сa2+ + 2OHˉ
Диссоциацию растворенной части амфотерного гидроксида можно представить следующей схемой:
H+ + МеO– = МеOH = Ме+ + OH –.
В насыщенном водном растворе амфотерного гидроксида ионы H+, МеO– и Ме+, OH– находятся в состоянии равновесия, поэтому амфотерные гидроксиды взаимодействуют и с кислотами и с основаниями. При добавлении кислоты равновесие смещается в сторону диссоциации по типу основания, при добавлении основания – в сторону диссоциации по типу кислоты.
Соли – это электролиты, диссоциирующие с образованием катионов, отличных от ионов Н+, и анионов, отличных от ионов ОНˉ:
NaCl = Na+ + Clˉ
KHCO3 = K+ + HCO3ˉ
AlOHCl2 = AlOH2+ + 2Clˉ
Лекция № 12. Гидролиз солей
Гидролиз солей – это обменное взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита и как правило сопровождается изменением pH-среды.
В заимодействие
катионов с водой происходит по
донорно-акцепторному механизму:
заимодействие
катионов с водой происходит по
донорно-акцепторному механизму:
C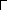 u2+
+ :O-H
= CuOH+
+ H+.
u2+
+ :O-H
= CuOH+
+ H+.
В заимодействие
анионов с водой происходит с образованием
водородной связи:
заимодействие
анионов с водой происходит с образованием
водородной связи:
СО32- + Н-О = НСО3¯ + ОН¯.
Катионы сильных оснований и анионы сильных кислот не образуют слабых электролитов, поэтому гидролизу не подвергаются.
В зависимости от ионов, входящих в состав солей, в растворе могут устанавливаться следующие равновесия:
а) при гидролизе аниона (A¯) слабой кислоты: А¯+ HOH = HA + OH¯
(образуются ионы OH¯, среда щелочная, pH>7);
б) при гидролизе катиона (B+) слабого основания: B+ + HOH = BOH + H+
(образуются ионы Н+, среда кислая, pH<7);
в) при гидролизе катиона слабого основания и аниона слабой кислоты:
А¯ + НОН = НА + ОН¯, В+ + НОН = ВОН +Н+
Гидролиз солей, образованных многоосновными кислотами или многокислотными основаниями, протекает ступенчато, с образованием кислых или основных солей, преимущественно по первой ступени.
Таким образом, можно выделить три типа гидролиза:
-
гидролиз по аниону – такому гидролизу подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты:
Na2CO3 + H2O =
(особенность написания реакций гидролиза: сначала пишут ионные реакции, а затем молекулярное уравнение)
2Na+ + CO32- + HOH = 2Na+ + HCO3¯ + OH¯
CO32- + HOH = HCO3¯ + OH¯ (pH > 7)
Na2CO3 + H2O = NaHCO3 + NaOH
-
гидролиз по катиону – подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты:
CuSO4 + H2O =
Cu2+ + SO42- + HOH = CuOH+ + SO42- + H+
Cu2+ + HOH = CuOH+ + H+ (pH < 7)
2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4
-
гидролиз по катиону и аниону – подвергаются соли, образованные катионом слабого основания и анионом слабой кислоты:
CH3COONH4 + H2O =
CH3COO¯ + NH4+ + HOH = CH3COOH + NH4OH (pH≈7)
CH3COONH4 + H2O = CH3COOH + NH4OH
Гидролиз является обратимым процессом. В соответствии с принципом Ле Шателье введение дополнительного количества ионов H+ или OH+ в равновесную систему может усилить или подавить процесс гидролиза. Гидролиз является эндотермическим процессом, поэтому повышение температуры приводит к усилению гидролиза.
