
- •Курсовая работа
- •Методы генетической трансфекции в генной терапии……………………………………………………………………………16
- •Краткая историческая справка
- •Методы генетической трансфекции в генной терапии
- •Принципы генной терапии
- •Генотерапия моногенных наследственных заболеваний
- •Генотерапия ненаследственных заболеваний
- •Некоторые этические и социальные проблемы
- •Генная терапия
- •Методы генетической трансфекции в генной терапии
- •Вирусы в качестве средств доставки генетического материала
- •10. Искуственные транспортные средства
- •10.1. Полимеры
- •10.2. Липосомы
- •Механизмы липофекции
- •11.1. Доставка днк к поверхности клеток
- •11.2. Взаимодействие комплексов с клеточной поверхностью и проникновение в цитоплазму
- •11.3. Освобождение днк в цитоплазму и транспорт в ядро
- •Моральные проблемы генной терапии
- •Заключение
-
Моральные проблемы генной терапии
Пока в области генной терапии многое неясно, трудно предусмотреть все последствия переноса генетического материала в человеческий организм, а также оценить его терапевтическую эффективность. Поэтому существует международный запрет на проведение испытаний на половых клетках и клетках ранних доимплантационных зародышей человека, чтобы предотвратить передачу неблагоприятных генетических изменений потомкам, не допустить засорения генофонда нежелательными искусственными генными конструкциями или внесения мутаций с непредсказуемыми последствиями для будущего человечества.
Ф. Андерсон и Дж. Флетчер сформулировали три условия, которые сегодня общепризнанны. Для разрешения клинических испытаний в области генной терапии необходимо доказать в экспериментах на животных, что:
-
Нужный ген может быть перенесён в соответствующие клетки-мишени, где он будет функционально активен достаточно продолжительное время.
-
Будучи перенесённым в новую для себя среду, этот ген не потеряет свою экспрессию, то есть сохранит эффективность.
-
Такой перенос не вызовет неблагоприятных последствий в организме.
Вместе с тем в научной литературе всё чаще и настойчивее раздаются призывы к возобновлению дискуссии о целесообразности генокоррекции зародышевых и половых клеток человека.
Вот некоторые вопросы, которые должны быть решены в рамках предлагаемой генетиками широкой дискуссии по генной терапии.
-
Сможет ли в будущем генная терапия обеспечить столь полноценную генокоррекцию, которая не представит угрозы для потомства?
-
В какой мере полезность и необходимость генотерапевтической процедуры для одной супружеской четы перевесят риск такого вмешательства для всего человечества?
-
Сколь оправданы будут эти процедуры на фоне грядущего перенаселения планеты?
-
Как будут соотноситься генноинженерные мероприятия на человеке с проблемами гомеостаза общества и биосферы?
Таким образом, генетическая революция, апофеозом которой явилась генотерапия, не только предлагает реальные пути лечения тяжёлых наследственных и ненаследстевнных недугов, но и в своём стремительном развитии ставит перед обществом новые проблемы, решение которых настоятельно необходимо уже в ближайшем будущем.
Заключение
Появление принципиально новых технологий, позволяющих активно манипулировать с генами и их фрагментами, обеспечивающими адресную доставку новых блоков генетической информации в заданные участки генома, совершило революцию в биологии и медицине. Сам ген все чаще начинает выступать в качестве лекарства, применяемого для лечения не только моногенных, но и многих других, в том числе и значительно более распространенных недугов (опухолей, инфекций). Не за горами применение генотерапии и для борьбы с мультифакториальными заболеваниями (сердечно-сосудистыми, психическими, эндокринологическими и многими другими).
Обзор существующих данных позволяет прийти к заключению, что несмотря на усилия многих лабораторий мира все уже известные и испытанные in vivo и in vitro векторные системы далеки от совершенства. Если проблема доставки чужеродной ДНК in vitro практически решена, а доставка последней в клетки-мишени разных тканей in vivo успешно решается путем создания комбинированных рецептор-опосредованных конструкций. Всё еще нуждаются в серьезных доработках характеристики существующих векторных систем - стабильность интеграции, регулируемая экспрессия, безопасность. Стабильности экспрессии можно достич либо при интеграции чужеродной ДНК непосредственно в геном реципиента, либо путем обеспечения длительной персистенции экзогенной ДНК в ядре. Интеграция в геном достигалась только при использовании ретро-вирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем. Но при этом эти векторные конструкции должны включать только часть вирусных генов, например, гены обратной транскриптазы, ретровирусной интегразы, некоторые транспозоновые гены, парвови-русные rep-гены. Учитывая возможный мутагенный эффект случайной интеграции, весьма перспективным представляется создание достаточно стабильных эписомных векторов. Привлекательной в плане генной коррекции представляется возможность замены всего мутантного гена или его мутировавшей части на нормальный аналог, что может быть достигнуто путем гомологичной рекомбинации. При этом в идеале можно ожидать не только длительную персистенцию введенного гена, но и сохранение нормальной экспрессии. С этой целью в конструкции, используемые для переноса ДНК, включают агенты, повышающие частоту гомологичного спаривания, например, бактериальную рекомбиназу. В таких условиях частота гомологичной рекомбинации может превышать 2,5x1011. Этого достаточно для того, чтобы с помощью ПЦР отобрать нужные клоны клеток.
Весь накопленный огромный материал и созданные и создаваемые принципиально новые технологии все чаще будут приводить, сначала небольшим, а потом и серьезным успехам в лечении все увеличивающегося числа заболеваний человека. В конце концов генная терапия войдет в разряд важных, а может быть, и важнейших подходов практической медицины.
ПРИЛОЖЕНИЯ:
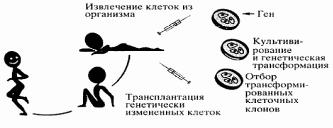
Рис. 1. Схема генной терапии ex vivo.
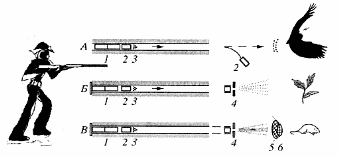
Рис. 2. Принцип конструкции ускорителя микрочастиц (генной пушки)
А - дробовое ружье: 1 - пороховой заряд, 2 - войлочный пыж, 3 - дробь;
Б - пороховой ускоритель Клейна и Стэнфорда: 1 - пороховой заряд, 2 - макроноситель (аналог пыжа), 3 - микрочастицы вольфрама, несущие вводимую ДНК, 4 - стопорная диафрагма для остановки микрочастиц:
В - ускоритель Колесникова: 1 - заряд гремучей ртути, 2 - макроноситель, 3 - смесь микрочастиц золота и вольфрама, покрытых вводимой ДНК, 4 - стопорная диафрагма для остановки микрочастиц, 5, 6 - сетчатые диафрагмы для удаления частей разрушенного макроносителя и дезинтеграции конгломерата микрочастиц соответственно.
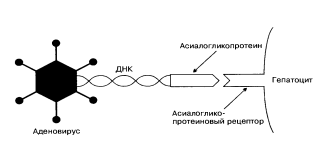
рис. 3. ДНК – поликатион.
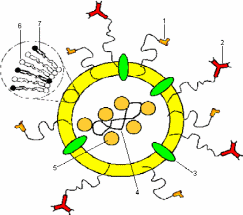
Рис.5.
"Идеальная" конструкция липосомы для направленной доставки лекарственного вещества в клетку; 1) Полимер для стерической защиты от клеток РЭС- Ретикуло-эндотелиальной системы ( например ПЭГ- полиэтиленгликолем); 2) "Молекулярный адрес" на полимерной ножке (в основном иммуноглобулины); 3) Белки слияния (например, гемагглютинин); 4) Лекарственное вещество (например, ДНК); 5) Липидные положительно заряженные частицы для компактизации ДНК; 6) Мембранообразующие липиды (фосфатидилхолин); 7) Липиды, дестабилизирующие мембрану (например, ФЭ-фосфатидилэтаноламин).
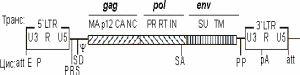
Рис. 6. Схема генома простого ретровируса (Mo-MuLV) и его генетические элементы с цис- и транс- функциями.
Элементы с цис-функциями - гены, кодирующие следующие белки:gag - MA (матриксный p15), р12, CA (капсидный p30), NC (белок нуклеокапсида p30) pol - PR (протеаза), RT (обратная транскриптаза/РНКаза Н), IN (интеграза) env - SU (поверхностный gp70), TM - трансмембранный белок.
Элементы с цис-функциями: Y-последовательность - сигнал упаковки/димеризации вирусной РНК аtt - последовательности, по которым идет интеграция в геном E, P - энхансер/промотор PBS - primer binding site - участок связывания специфической тРНК pA - сигнал полиаденилирования PP - полипуриновая последовательность SA, SD - акцепторный и донорный сайты сплайсинга.

Рис. 7. Cхематическое изображение ретровирусных векторов (в виде ДНК-провирусов) 1, 2 - использование разных промоторов для экспрессии двух генов; 3 - использование для экспрессии двух генов типичной для ретровирусов системы сплайсинга; 4 - использование IRES (internal ribosome entry site) последовательности, которая обеспечивает трансляцию полицистронных мРНК; 5 - вектор, кодирующий "fusion"-белок, нужен только один промотор Y- пси-область, ВП - внутренний промотор, SD,SA - донорный и акцепторный сайты сплайсинга, Стрелками показано направление транскрипции.
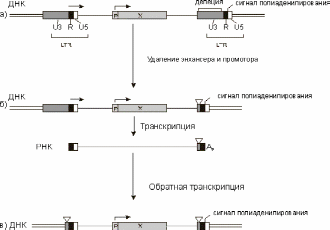
Рис. 8. Схематическое изображение структурно-функциональных изменений ретровирусного вектора, приводящих к делециям в промоторно-энхансерных областях обоих LTR а) - ретровирусный вектор (оба LTR содержат энхансерно-промоторную область) б) - самоинактивирующийся вектор в виде провируса в геноме упаковывающей клетки в) - самоинактивирующийся вектор в виде провируса, интегрированного в геном клетки-мишени трехугольник - делеция промоторно-энхансерной области; стрелка - направление транскрипции, задаваемой активным промотором; Р - внутренний промотор, Х - клонированные ген/гены .
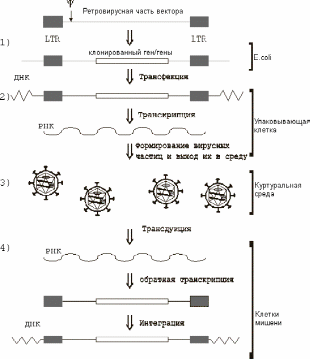
Рис. 10. Схема переноса генов с использованием ретровирусных векторов
Этапы переноса:
1. Клонирование гена (генов) в ДНК ретровирусного вектора
2. Трансфекция ДНК вектора с клонированным геном в упаковывающие клетки
3. Сбор культуральной среды упаковывающих клеток
4. Трансдукция гена в составе вектора в клетки-мишени
СПИСОК ЛИТЕРАТУРЫ:
1. Баранов В.С. Генная терапия – медицина XXI века // Соросовский образовательный журнал. – 1999. – № 3. – С. 63–68. (Санкт-Петербургский государственный университет)
2. Баранов В.С. "Генная терапия-медицина XXI века"; Ж. "Соросовский образовательный журнал", 1999. - №3. - С. 63.
3. Баранов В.С. Ж. "Природа", 1996. №8. - С. 25.
4. Бердышев Г.Д. Биологическая инженерия и старение, 1988. - Киев, "Выща шокла".
-
Вестник АМН СССР, 1990. - №8. – С. 35-37.
-
Ж. "Природа", 1991. - №2. - С. 109.
-
Тараховский Ю.С., Иваницкий Г.Р. "Липосомы в генной терапии. Структурный полиморфизм липидов и эффективность доставки генетической информации"; Ж. "Биохимия", 1998. - т.63, вып.1,№6.
-
Тищенко П.Д. "Ген-этика"; Ж. "Человек", 1996 год, №6. - С.67.
-
Шмек Х. "Генная терапия – новая надежда медицины"; Новая еженедельная газета, 1994. - приложение "Эврика"№7, 18 мая.
-
[1] http://www.textreferat.com/referat-3874-9.html
-
http://afonin-59-bio.narod.ru
-
http://afonin-59-salix.narod.ru
