
- •Общие вопросы автоматизации измерений
- •Механизация и автоматизация лабораторий
- •Дискретные анализаторы
- •Непрерывные анализаторы
- •Непрерывный проточный анализ (нпа)
- •Проточно-инжекционный анализ (пиа)
- •Центрифужные анализаторы
- •Элементные анализаторы
- •Лабораторные роботы
- •Химические сенсоры
- •Потенциометрические сенсоры
- •Газочувствительные сенсоры
- •Биокаталитические мембранные сенсоры
- •Амперометрические сенсоры
- •Кондуктометрические сенсоры
- •Оптические сенсоры первого поколения
- •Сенсоры с системами распознавания
- •Оптроды третьего поколения
- •Термические (калориметрические) сенсоры
- •Гравиметрические сенсоры
- •Многоканальные сенсоры
- •Автоматизированный контроль производственных процессов
- •Анализ на основе неселективных характеристик
- •7.4. Литература
- •Иммунный анализ
- •Введение
- •Варианты анализа
- •Конкурентный анализ
- •Сандвичевый анализ
- •Варианты устройства
- •Эффекты поверхностной иммобилизации
- •Физические методы разделения связанной и свободной метки
- •Адсорбция на твердых частицах
- •Метки Радиоактивные метки
- •Гаптены и полипептиды
- •Частицы, рассеивающие свет, в качестве меток
- •Флуоресцентные и хемилюминесцентные метки
- •Ферментные метки
- •7.9.4. Мешающие влияния
- •Эффективная концентрация определяемого вещества
- •Эффективность связывания антител
- •D Биосенсоры—это аналитические устройства.
- •Биораспознающий компонент и преобразователь
- •Создание биологической поверхности
- •Методы иммобилизации
- •Подготовка биопреобразования Амперометрические сенсоры
- •Потенциометрические сенсоры
- •Оптические сенсоры
- •Оптическое детектирование без метки
- •7.8.4. Заключение
- •Обработка сигналов: цифровая фильтрация, преобразование данных
- •Отношение сигнал-шум
- •Аналоговые и цифровые фильтры
- •Фильтрация при помощи скользящего среднего
- •Полиномиальное сглаживание: фильтр Савицкого-Голея
- •Дифференцирование и интегрирование данных
- •4.3 Фильтрация данных с предварительным преобразованием сигнала
- •Фурье-преобразование
- •Дискретное фурье-преобразование
- •Обратное фурье-преобразование
- •Фильтрация данных при помощи фурье-преобразования
- •Литература.
-
Ферментные метки
Общий принцип
Ферментные метки непосредственно не участвуют в измерении, но поскольку они вызывают превращение многих субстратных молекул на одну молекулу фермента, существует высокий потенциал усиления.
Ферменты служат, пожалуй, наиболее широко используемыми в иммунном анализе метками, однако они непосредственно не участвуют в измерении, в отличие от изотопов или флуоресцентных меток. Вместо этого, измерение может включать детектирование расхода ферментного субстрата или накопления продукта, требуя, таким образом, наличия в анализе другого реагента и привнося в метод дополнительные сложности. Тем не менее, поскольку одна молекула фермента может вызвать превращение многих молекул субстрата, имеется очень высокий потенциал усиления сигнала, и это преимущество перевешивает часто упоминаемый недостаток несовместимой оптимизации условий конечного этапа ферментативного анализа и связывания антитело—антиген.
Наиболее часто в качестве меток используют два фермента — щелочную фосфатазу (ЩФ) и пероксидазу хрена (ПХ). Выбор зависит от возможности оптического детектирования превращения субстратов этих ферментов и от легкости соединения фермента без потери активности. Щелочная фосфатаза представляет димерный гликопротеин с молекулярной массой 140 000, содержащий много свободных аминокислот для соединения. Аналогично пероксидаза хрена содержит четыре лизиновых остатка для соединения и имеет молекулярную массу 44000. В некоторых случаях для соединения можно использовать углеводные остатки.
Разработаны методы соединения фермента с антителом или антигеном в соответствии с конечным вариантом и специальными требованиями иммунного анализа. Существуют два главных подхода: гомобифункциональные агенты и гетеробифункциональные агенты. Многие из используемых реагентов те же, что и уже рассмотренные при образовании конъюгатов с радиоактивной меткой (см. табл. 7.9-2), и здесь можно применить похожее рассмотрение за исключением того, что в этом случае конъюгат образует связь с белком-меткой. Может оказаться необходимым защитить активное место фермента в процессе соединения за счет включения субстрата фермента в процессе приготовления; это особенно важно, когда происходит соединение фермента с гаптеном, поскольку гаптен может образовать связь или закрыть активное место, маскируя места распознавания и гаптена, и фермента.
Соединение с гаптеном должно, вообще говоря, использовать ту же группу, что и для образования иммуногена в первом случае, так чтобы лиганд не маскировал место распознавания. Например, в большинстве определений гидрокортизона применяют сыворотку, полученную с помощью конъюгата кортизон-3-(0-карбоксиметил)оксима, поскольку это оставляет уникальное 17 положение D-кольца доступным для распознавания, создавая, таким образом, специфичность к кортикостероидной структуре (рис. 7.9-15). Конъюгат же с гаптеном, меченый в положении С-21, не проявляет затем сродства к антителу, так что этот анализ терпит неудачу.
Присоединение ферментной метки не должно блокировать место распознавания!
Точно так же, как может потребоваться разделяющая молекула между гаптеном и белком для образования иммуногена, способность меченого конъюгата к связыванию с антителом можно улучшить, если поместить подходящий разделитель между гаптеном и ферментом. Наиболее популярным гомобифунк-циональным агентом для присоединения фермента является глутаровый альдегид, но он склонен к образованию очень гетерогенных комплексов, с существенным кросс-линкингом фермент-фермент наряду с желаемым фермент-конъюгат. Гетеробифункциональные агенты позволяют обойти эту проблему с различной степенью успеха, зависящей от относительной реакционной способности разных групп. Широко используют N-гидроксисукцинимидный эфир дималеимида и карбодиимиды, но доступны многие другие соединительные агенты (см. также разд. 7.8.2).
Гомогенный ферментативный иммунный анализ
Интересным развитием идеи использовать ферментные метки является контроль соотношения «связанныйхвободный» путем изменения активности фермента в результате связывания в конъюгат с антителом или дополнительного связывания антиферментных антител. Такие способы анализа не нуждаются в этапе разделения, а значит, можно упростить проведение определения. Разработано несколько способов гомогенного ферментативного иммунного анализа (ФИА).
Умножающий ферментативный иммунный анализ (УФИА)
В конкурентном анализе гаптен, меченный ферментом, может конкурировать с гаптеном пробы за ограниченный запас антигаптеновых антител. Если связывание антитела с гаптеновым конъюгатом ингибирует активность фермента, то чем выше концентрация гаптена в пробе, тем меньше связывание антитела с конъюгатом, и, следовательно, тем меньше ингибирование (рис. 7.9-16). В первом варианте метода УФИА разработанном для морфина, в качестве фермента, чувствительного к ингибированию, использовали лизоцим, но было найдено, что глюкозо-6-фосфат — дегидрогеназа является наиболее эффективной для этого метода в отношении изменения ферментативной активности. При-
Рис. 7.9-15. Гидрокортизон, иллюстрирующий общую структуру стероидов, с уникальным центром «распознавания» для гидрокортизона в С-17. Соединение через С-3 не маскирует этот центр.
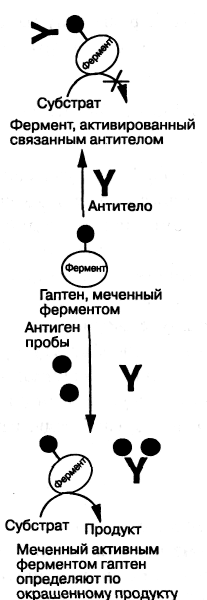
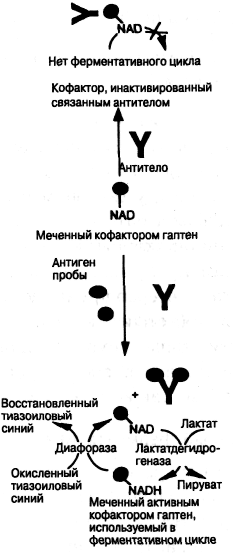

Рис.
7.9-16. Принцип
умножающего ФИА-анализа. Антитело,
связанное с ферментом — меткой гаптена,
меняет активность фермента.
ложения УФИА направлены также на определяемые вещества с низкой молекулярной массой, в особенности из семейства наркотиков и терапевтических агентов. Основным недостатком этого метода является медленное установление равновесия с гаптеном в растворе, так что необходимо предварительное выдерживание пробы и антител перед добавлением ферментного конъюгата. Для определяемых веществ с большей молекулярной массой можно использовать модификации основного принципа.
Метка — кофактор фермента
Преимущество использования в качестве метки кофактора фермента, а не самого фермента, заключается в том, что его можно легко включить в схему усиления (рис. 7.9-17) и использовать в системе гомогенного анализа. Применяют конъюгаты гаптен-кофактор (например, NAD-гаптен), и в присутствии соединения фермент-NAD и субстрата конъюгат, связанный с антителом, неактивен, тогда как свободный конъюгат способен участвовать в ферментативном цикле. Каждый раз, когда конъюгат гаптен-кофактор претерпевает цикл уси-
|
Косубстрат |
Атах (окисленная форма), нм |
|
2,2'-азинобис(этилбензотиазолин-6-сульфонат) (АБТС) о-Фенилендиамин (ОФД) 3,3', 5,5'-Тетраметилбензидин (ТМБ) |
415 492 (подкисленная) 450 (подкисленная) |
2,2'-азинобис(этилбензотиазолин-6-сульфонат) (АБТС) 415
о-Фенилендиамин (ОФД) 492 (подкисленная)
3,3', 5,5'-Тетраметилбензидин (ТМВ) 450 (подкисленная)
ления, образуется стехиометрическое количество продукта, и количество продукта накапливается по мере протекания анализа.
Образование сигнала
Образование колориметрического сигнала
D Для проведения колориметрического иммунного анализа с ферментной меткой ферментативная реакция должна приводить к образованию окрашенного продукта.
Принципиальная идея здесь заключается в том, что ферментный субстрат следует превратить в окрашенный продукт. В случае щелочной фосфатазы обычно используют n-нитрофенилфосфат или аналогичный ароматический фосфат:
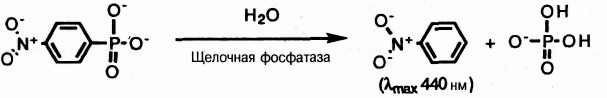
но показано, что пероксидаза хрена проявляет большую чувствительность. В последнем случае метка действует как косубстрат с пероксидом и донором водорода. Конечным продуктом является окисленный донор водорода, который выбирают в соответствии с его способностью поглощать в видимой области. В табл. 7.9-5 приведены распространенные косубстраты пероксидазы, имеющие подходящие абсорбционные характеристики в окисленном виде. 3,3', 5,5'-Тетраметилбензидин (ТМБ) дает наибольшее поглощение и наиболее низкий фон в сравнении с многими другими используемыми субстратами, такими, как 2,2'-азинобис(этилбензотиазолин-6-сульфонат) (АБТС) или о-фенилендиамин.
Образование флуориметрического сигнала
Щелочная фосфатаза (ЩФ) больше подходит для флуоресцентных измерений, чем пероксидаза хрена (ПХ). Наиболее часто применяемым субстратом служит 4-метилумбеллиферилфосфат, который испускает свет при 448 нм при возбуждении на длине волны 365 нм. Следовательно, преимуществом ЩФ является то, что флуоресцирующее соединение можно фосфорилировать, создав, таким образом, флуорофорный субстрат для довольно неспецифичного фермента ЩФ. В принципе, можно синтезировать широкий класс флуорофоров с различными флуоресцентными свойствами и временами затухания в качестве подходящих субстратов для ферментной метки. Такой ферментативный подход
к флуоресцентным измерениям имеет очевидное преимущество более сильного сигнала в сравнении с обычной флуорофорной меткой, поскольку каждая ферментная метка создает много флуоресцирующих молекул.
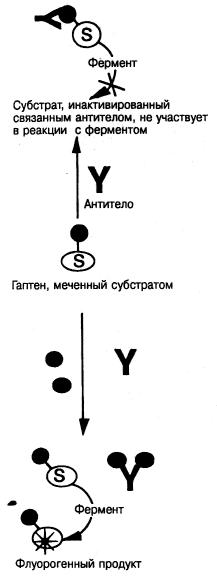
Однако это справедливо не во всех случаях, например, в анализе, основанном на принципе УФИА, где гаптен маркирован субстратом и образует флуорогенный продукт при ферментативном катализе только тогда, когда не образуется комплекса с антителом (рис. 7.9-18). В этом случае конъюгат /3-галактозилумбеллиферона и гаптена может участвовать в качестве меченого аналога определяемого вещества в конкурентном анализе с ограниченным количеством антител. Комплекс антитела с гаптеновым конъюгатом ингибирован как субстрат для фермента /3-галактозидазы, тогда как оставшийся свободным конъюгат гидролизуется ферментом, образуя флуорогенный продукт.
Образование хемилюминесцентного сигнала
D Биолюминесценция предлагает очень чувствительный способ определения ферментной метки.
Щелочная фосфатаза особенно полезна при разработке способов генерации люминесцентного сигнала, поскольку многие ароматические фосфаты при отщеплении фосфатной группы образуют неустойчивый анион, который распадается с испусканием света (например, адамантил-1,2-диоксентанарилфосфат). Однако большинство выполняемых люминесцентных измерений основаны на
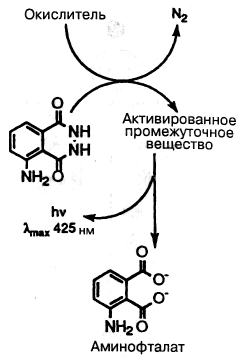
Схема 7.9-4. Хемилюминесцентное окисление люмино-ла с помощью пероксидазы хрена.
использовании пероксида. Люминол как косубстрат пероксида окисляется ПХ, образуя неустойчивый промежуточный продукт, который распадается до 3-аминофталата с испусканием света (схема 7.9-4). Хотя хемилюминесцентные реакции могут давать весьма чувствительные измерения, они, тем не менее, обычно имеют квантовый выход менее 20%.
Можно увеличить сигнал от реакции на схеме 7.9-4 на несколько порядков величины, добавляя «усилитель» (рис. 7.9-19). Такими усилителями обычно служат фенолы и нафтолы, хотя показано, что другие молекулы тоже проявляют эффект (табл. 7.9-6). Точный механизм этого усиления до конца не ясен. Однако вероятно, что усилитель действует как переносчик радикала между ферментативными реакциями с пероксидом и люминолом, улучшая, таким образом, «медленный этап» образования люминольных радикалов.
Биолюминесценция также представляет хемилюминесцентный метод, связанный в первую очередь с механизмом, отвечающим за образование света светляками. Он включает фермент люциферазу, которая катализирует окисление гетероциклической органической молекулы (люциферина). Люциферины имеют различную структуру, но многие из реакций, катализируемых люциферазой, включают такие кофакторы, как АТР (АТФ), FMN (флавинмо-нонуклеотид) или NADH, так что использование этих кофакторных меток (см. рис. 7.9-17) вводит цикл в катализируемый люциферазой механизм (схема 7.9-5). С другой стороны, с помощью NAD-ферментной метки получают ферментативное усиление. Например, на рис. 7.9-20 показан ферментативный цикл, инициируемый NAD+, который приводит к люминесцентному сигналу. Такие определения NADH могут давать низкий предел обнаружения на уровне 10~15моль NADH с линейностью свыше пяти порядков величины.
