
- •Лекція № 9 Молекулярна спектроскопія
- •1. Загальні відомості про молекулярні спектри
- •2. Абсорбційна спектроскопія в уф- і видимої областях
- •Способи визначення концентрації
- •Метрологічні характеристики спектрофотометричного методу
- •3. Інфрачервона спектроскопія Походження іч-спектрів
- •4. Люмінесцентна спектроскопія
4. Люмінесцентна спектроскопія
Основи методу
Люмінесценцією називають світіння атомів, молекул та інших часток, що виникає в результаті електронного переходу при поверненні їх зі збудженого стану в основний.
Для збудження люмінесценції необхідно підводити енергію ззовні, оскільки вона витрачається при випромінюванні. Тому види люмінесценції класифікують по зовнішньому джерелу порушення енергії. У табл. 2. вказані види люмінесценції залежно від способу збудження часток.
Таблиця 2. Види люмінесценції залежно від способу збудження часток
-
Спосіб збудження
Вид люмінесценції
Електромагнітне випромінювання (УФ, видиме світло)
Фотолюмінесценція
Енергія хімічних реакцій
Хемілюмінесценція
Енергія хімічних реакцій, що протікають у живих організмах
Біолюмінесценція
Рентгенівське випромінювання
Рентгенолюминесценція
Електрична енергія
Электролюминесценція
Із всіх видів люмінесценції в аналітичній хімії частіше використовують фотолюмінесценцію.
Люмінесцентна спектроскопія відрізняється високою чутливістю й відтворюваністю. Ці фактори визначили розвиток люмінесцентного методу аналізу.
Люмінесценцію часто спостерігають у повсякденному житті. Здатністю до неї мають деякі види мікроорганізмів, комах і глибоководних риб. Світяться екрани телевізорів, на сонячному світлі люмінесцирують деякі тонізуючі напої (через добавки хініну); бензин, що містить поліциклічні ароматичні вуглеводні (нафталін, антрацен і ін.); деякі ліки й наркотики. Світяться деякі мінерали й руди (наприклад, уранові).
Поняття про синглетний і триплетний стани молекул
Найбільш стійким станом більшості молекул є синглетний (S), тобто стан із сумарним спіном, рівним нулю. У синглетному стані електрони, що займають одну орбиталь, антипаралельні. Електронні переходи без зміни спина називають синглет-синглетними, наприклад S0→S1, S0→S2, S1→S0. З них перші два переходи відбуваються при поглинанні світла, останній − при випущенні.
У триплетному стані (Т1, Т2 і т.д.) спини збудженого електрона й електрона, що залишився в основному стані, паралельні й сумарний спин дорівнює одиниці. У триплетному стані молекули легко дезактивируються. Наприклад, вони втрачають свою енергію в безпроменевих процесах з виділенням теплоти, при взаємодії з молекулами, що мають неспарені електрони (наприклад, з молекулами О2), при зіткненнях з іншими частками.
Переходи між синглетним і триплетним станами заборонені (правило відбору, по якому заборонені переходи зі зміною спина електрона). У присутності важких атомів (наприклад, галогенів) заборона не діє , тому такі переходи з випромінюванням стають можливими.
Походження люмінесценції
Молекула, поглинаючи квант світла, переходить із основного стану S0 у збуджений електронний стан, наприклад S1. При кімнатній температурі молекули перебувають в основному коливальному стані. Переходячи в збуджений стан, молекула попадає на один з підрівней наступних коливальних рівнів.
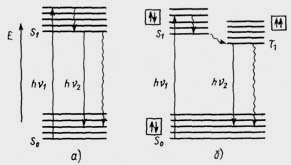 Рис.5.
Схема енергетичних переходів молекули,
що ілюструє виникнення флуоресценції
(а) і фосфоресценції (б) (схема Яблонського)
Рис.5.
Схема енергетичних переходів молекули,
що ілюструє виникнення флуоресценції
(а) і фосфоресценції (б) (схема Яблонського)
Поглинання молекулою кванта світла здійснюється за дуже короткий час (10–15 с). Потім відбувається перехід електрона на нижній коливальний підрівень збудженого стану (10–12 с). Цей процес називають коливальною релаксацією.
Повернення молекули з нижнього коливального стану S1 у незбуджений стан S0 може відбутися трьома шляхами:
1) втрата молекулою енергії у вигляді теплоти в результаті зіткнень із іншими частками (процес внутрішньої конверсії);
2) повернення молекули на будь-який коливальний підрівень основного стану з випущенням енергії у вигляді кванта світла без зміни спина електрона (флуоресценція);
3) перехід молекули зі збудженого стану S1 у метастабільний стан Т1, а потім в основний S0 або в результаті внутрішньої конверсії з виділенням теплоти, або з виділенням кванта світла (фосфоресценція).
Флуоресценція спостерігається набагато частіше фосфоресценції, особливо в рідких розчинах. Інтенсивна фосфоресценція спостерігається в органічних сполук у замороженому або в склоподібному стані, коли дифузія мінімальна.
Характеристики та закономірності люмінесценції
Вихід люмінесценції. Частина поглиненої енергії при фотолюмінесценції витрачається на безвипромінювальні переходи, тобто не всі поглинені кванти світла перетворяться в люмінесценцію. Тому енергія квантів, що випускаються, завжди менше енергії квантів, що поглинаються:
hпог > hл.
Ефективність перетворення енергії збудження в люмінесцентне випромінювання можна охарактеризувати енергетичним E і квантовим л виходами люмінесценції:
E = Eл /E пог (1)
lum = Nл/Nпог, (2)
де Eл і E пог – енергії випромінювана й що поглинається; Nл і Nпог – числа квантів випроменених і поглинених відповідно. Енергетичний і квантовий виходи зв'язані між собою
E = л ·(vл /vпог).
Спектр люмінесценції. Залежність інтенсивності люмінесценції від довжини хвилі або частоти випромінювання називають спектром люмінесценції. Вид спектра не залежить від довжини хвилі збуджуючого світла, тому що випромінювання завжди відбувається з нижчого коливального рівня першого збудженого стану незалежно від того, який квант поглинається молекулою й на який енергетичний рівень вона при цьому перейде.
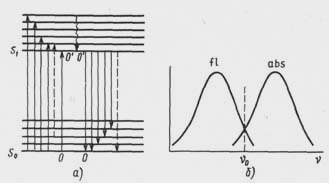 Рис.
6. Схема, що ілюструє закон Стокса-Ломмеля:
а –
енергетичні переходи; б
– спектри поглинання
й флуоресценції
Рис.
6. Схема, що ілюструє закон Стокса-Ломмеля:
а –
енергетичні переходи; б
– спектри поглинання
й флуоресценції
Закон Стокса — Ломмеля. Втрата частини енергії квантів світла, що поглинаються, на безвипромінювальні процеси приводить до того, що квант, що випускається, має меншу енергію й, отже, більшу довжину хвилі, чим поглинений. За законом Стокса – Ломмеля спектр флуоресценції в цілому і його максимум зміщені в порівнянні зі спектром поглинання і його максимумом у бік довгих хвиль.
Різниця довжин хвиль у максимумах спектрів флуоресценції й поглинання називають стоксовым зміщенням. Існує область довжин хвиль, де кванти флуоресценції мають більшу енергію, чим поглинені (антистоксова область). Це пояснюється тим, що мала частина молекул речовини може перебувати на різних (але не на нижчому) коливальних рівнях основного стану. У цьому випадку енергія переходів у збуджений стан може виявитися менше енергії випромінювання.
Спектри поглинання й флуоресценції перетинаються в точці при v0, що відповідає збудженню електрона й випромінюванню кванта без втрат на безвипромінювальні переходи (0→ 0', 0' → 0).
Правило дзеркальної симетрії В. Л. Левшина. Коливальна структура багатьох великих органічних молекул при збудженні практично не змінюється, тому нормовані спектри поглинання й флуоресценції, зображені у функції частот, дзеркально симетричні відносно прямій, що проходить через точку перетинання перпендикулярно осі частот (правило В. Л. Левшина). (Нормованими називають спектри, приведені до одного максимуму. Спектри необхідно нормувати, тому що інтенсивність поглинання й випромінювання одержують у різних одиницях. Для порівняння спектри попередньо перетворять так, щоб їхньої амплітуди були однакові в максимумах)
Дотримання правила дзеркальної симетрії дозволяє побудувати спектр флуоресценції або поглинання, маючи тільки один з них.
Зв'язок інтенсивності флуоресценції й концентрації. При проходженні потоку світла через розчин з концентрацією Із частину потоку поглинається, однак у флуоресценцію перетвориться лише частина поглиненого світла, що виражається квантовим виходом флуоресценції ф = л. Інтенсивність флуоресценції 1ф пропорційна числу квантів флуоресценції:
1 ф = ф Iпог,
Інтенсивність поглинання світла Iabs є різницею між інтенсивностями падаючого світла (10) і минулого через шар довжиною l (Il):
Закон Бугера − Ламберта− Бера для люмінесценції має вигляд:
1ф =ф I0 1С або 1ф = k.
Таким чином, при малих концентраціях спостерігається прямолинійна залежність інтенсивності флуоресценції від концентрації.
Погашення люмінесценції. Зменшення квантового виходу люмінесценції називають погашенням. Воно може бути викликано різними причинами. Ослаблення світіння звичайно спостерігається з підвищенням температури (температурне погашення), а також під впливом багатьох речовин, у тому числі самої люміинесцируючої речовини (самопогашення або концентраційне погашення). Причиною концентраційного гасіння можуть бути хімічні зміни в системі. Наприклад, у результаті агрегації молекул можуть утворитися асоціати, що не мають здатністі до люмінесценції або мають інші спектральні характеристики. Гасіння спостерігається також у присутності домішок, наприклад кисню, іонів перехідних металів, важких атомів І–, Вr–).
Апаратура
Для виміру флуоресценції використовують спектрофлуориметри. Основними вузлами в них є джерела збудження (ртутно-кварцові, ксенонові й ін. лампи, що дають випромінювання в УФ- і видимої областях), пристрої для виділення спектрального діапазону (призменні та дифракційні монохроматори (у спектрофлуориметрах) і світлофільтри (у флуориметрах). Для детектування люмінесцентного випромінювання використовують фотоумножники, що перетворять світловий сигнал в електричний і лічильники фотонів.
Звичайно в конструкціях флуориметрів джерело збудження, кювету з досліджуваним розчином і детектор розташовують під прямим кутом до падаючого світла. Світло від ртутно-кварцової лампи попадає на первинний світлофільтр, що пропускає випромінювання з довжинами хвиль збудження, і далі на кювету з досліджуваним розчином. Люмінесцентне випромінювання, що випускається, попадає на вторинний світлофільтр, що пропускає люмінесцентне випромінювання й затримує збуджуюче та розсіяне випромінювання.
Застосування люмінесценції
Люмінесценцію використовують для виявлення й визначення багатьох неорганічних і органічних сполук.
Іони деяких елементів у рідких розчинах мають власну люмінесценцію. Таке світіння спостерігається для 4 f-елементів – лантаноїдів з вищою ступеню окиснення. Флуоресцентний аналіз є кращим для визначення малих кількостей урану.
У заморожених розчинах власною люмінесценцією мають галогенідні комплекси T1(I), Pb(II), Sn(II), Bi (III), Sb (III), Ті (IV), що використовують не тільки для високочутливого й селективного визначення цих елементів, але й для їх виявлення. Наприклад, якщо краплю аналізованого розчину, що містить Bi (III) і Sb (III) у НС1, нанести на фільтрувальний папір і опустити в рідкий азот, то при опроміненні УФ-світлом спостерігається синє світіння хлоридних комплексів Bi (III). Після додавання до аналізованого розчину НBr зۥявляється червоне світіння бромідних комплексів Sb(III).
Власна люмінесценція характерна й для кристалофосфорів – матеріалів, виготовлених на основі сульфідів цинку, кадмію, стронцію, барію, хлориду калію; вольфраматів і силікатів кальцію й магнію, активованих іонами елементів. Люмінесценцію кристалофосфорів застосовують в аналітичній практиці як високочутливий і селективний метод визначення лантанидів, урану, деяких d-перехідних елементів.
Для іонів деяких лантанидів Sm, Eu, Tb, Dy, Nd і Yb власна люмінесценція спостерігається у комплексних сполуках з органічними реагентами, наприклад -дикетонами, N-Гетероцикличними основами й амінополікарбоновими кислотами. Інтенсивність люмінесценції таких сполук у тисячі разів вище, ніж водних розчинів неорганічних солей, а спектри випромінювання, зумовлені електронними переходами усередині 4 f-оболонки іона, залишаються лінійчатими.
В аналітичній практиці найбільше значення мають методи, засновані на утворенні люмінесцируючих (частіше флуоресціюючих) комплексів іонів неперехідних металів (Al, Be, Са, Мп, Zn і ін.) з органічними реагентами. У таких комплексах іон металу зۥєднується з одною або декількома молекулами хелатоутворюючого реагенту, що приводить до утворення твердої структури, яка містить кілька систем конденсованих кілець, що оточують центральний іон-комплексоутворювач. Наслідок цього − батохромне зміщення спектра поглинання комплексу й поява або збільшення люмінесценції. Прикладами флуоресціюючих речовин є 8-оксихінолинат алюмінію, комплекси алюмінію й берилію з поліоксипохіднимми флавону, магнію з оксіазосполуками.
Великий клас люмінесцентних реагентів становлять родамінові барвники, які з металогалогенидними комплексами, наприклад GaCl4–, InBr4–, утворюють флуоресціюючі асоціати.
Люмінесцентний аналіз – один із самих чутливих методів і застосовується для визначення слідових кількостей елементів. На відміну від спектрофотометрії, де вимірюють різницю двох сигналів (І0 і Іl), у люмінесценції вимірюють сам сигнал, і межа виявлення залежить від інтенсивності джерела й чутливості детектора. Метод люмінесценції дозволяє визначати 10–10–4 мкг·мл –1 речовини.
Методи, засновані на власній люмінесценції речовин, дуже селективні на відміну від методів визначення елементів, що використовують органічні реагенти. Вибірковість люмінесцентного аналізу можна підвищити, варіюючи експериментальні умови (довжину хвилі збудження й реєстрації сигналу, час спостереження у фосфоресцентних методах, хімічні параметри, наприклад рН розчину, температуру й т.д.).
Люмінесценцію широко застосовують для визначення органічних речовин (наприклад, вітаміни, ліки, наркотики).
