
- •Лекція № 9 Молекулярна спектроскопія
- •1. Загальні відомості про молекулярні спектри
- •2. Абсорбційна спектроскопія в уф- і видимої областях
- •Способи визначення концентрації
- •Метрологічні характеристики спектрофотометричного методу
- •3. Інфрачервона спектроскопія Походження іч-спектрів
- •4. Люмінесцентна спектроскопія
Способи визначення концентрації
Для знаходження концентрації досліджуваної речовини викостовують декілька способів.
Метод градуйованого графіка. Готовлять серію з 4 – 6 розчинів визначуваної речовини з відомою концентрацією, вимірюють їх оптичну густину при вибраній довжині хвилі й товщині кювети, будують графік залежності А = f(С). Якщо виходить пряма лінія (тобто розчини підкоряються закону Бугера – Ламберта – Бера), її можна описати рівнянням y = ах + b, де х – концентрація розчину C; y – його оптична густина А; а – кутовий коефіцієнт, дорівнює коефіцієнту поглинання (якщо використано молярну концентрацію, те а = ); b – відрізок на осі оптичної густини, що відтинається прямою, є значенням оптичної густини в холостому досліді − Ахол. Після побудови градуйованого графіка вимірюють А досліджуваного розчину і по графіку визначають невідому концентрацію.
Диференційна фотометрія використовується для визначення високих концентрацій речовин, якщо звичайні методи не підходять через великі значення оптичної густини. Для зменшення цих показників досліджуваний розчин можна розбавляти (при цьому можливі побічні процеси, наприклад, посилення гідролізу й ін.), або використовувати як розчин порівняння розчин з досить великою концентрацією визначуваної речовини. Важливо те, щоб розчин порівняння мав менше значення А, ніж досліджуваний.
При використанні цього методу готують два розчини, які містять усі компоненти анализируємої системи. Один з них, з відомою невеликою концентрацією, виконує роль розчину порівняння. Кювету з ним поміщають на шляху світлового пучка й установлюють стрілку індикаторного пристрою на нулі. Другий розчин з невідомою концентрацією поміщають в іншу кювету й вимірюють його оптичну густину Ах відносно першого розчину. Розрахунок проводять по формулі
Ах = l(Сх − С0 ).
Метод додатків використовується при аналізі невеликої кількості зразків, якщо побудова градуйованого графіка недоцільна. Він дає можливість виключити вплив компонента розчину, що аналізується. Спочатку вимірюють оптичну густину розчину з невідомою концентрацією Сх визначуваної речовини – Ах. Далі в досліджений розчин уводять відому кількість розчину з відомою концентрацією цієї речовини Са й знову вимірюють оптичну густину розчину Ах+а. Невідому концентрацію знаходять розрахунком або графічним шляхом.
Оптична
густина. дослідженого розчину Ах
= Схl,
розчину з додатком Ах+а
= Сх+а
l.
Виходячи із цих рівнянь Сх
=![]() .
.
При графічному способі знаходження невідомої концентрації розчину проводять наступне.
У трьох однакові мірні колби вносять однакові кількості дослідженого розчину, у другу й третю колби додають певні кількості цього розчину – а1 і а2. Вимірюють оптичні густини цих розчинів – Ах, Ах+а1, Ах+а2 На осі абсцис відкладають додаткові кількості стандартного розчину, на осі ординат – відповідні ним оптичні густини розчинів. Через отримані три точки проводять пряму лінію до перетинання її з віссю концентрації. Абсолютне значення відрізка ОСх відповідає невідомої концентрації розчину.
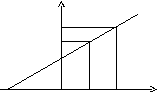 А
А
А2
А1
Ах
 а1
а2
С
а1
а2
С
Сх.
Метод спектрофотометричного титрування. В ньому перемінною величиною є оптична густина розчину з невідомою концентрацією або розчину титранта. Досліджений розчин у прозорій посудині поміщають на шляху світлового потоку, додають титрант порціями при перемішуванні й вимірюють оптичну густину після кожного додавання.
У с-ф титруванні криві титрування будують в координатах концентрація С титранта (об'єм) – оптична густина А. При цьому одержують прямі, що перетинаються в точці еквівалентності. Поблизу точці еквівалентності звичайно спостерігається деяке скривлення прямих. Це пов'язане з неповнотою протікання реакції під час відсутності надлишку того або іншого компонента. Тому для знаходження точці еквівалентності проводять екстраполяцію прямолінійних ділянок кривих до перетинання.
