
- •Лекція № 9 Молекулярна спектроскопія
- •1. Загальні відомості про молекулярні спектри
- •2. Абсорбційна спектроскопія в уф- і видимої областях
- •Способи визначення концентрації
- •Метрологічні характеристики спектрофотометричного методу
- •3. Інфрачервона спектроскопія Походження іч-спектрів
- •4. Люмінесцентна спектроскопія
Лекція № 9 Молекулярна спектроскопія
-
Загальні відомості про молекулярні спектри
-
Абсорбційна спектроскопія в УФ- і видимої областях
-
ІЧ-спектроскопія
-
Люмінесцентна спектроскопія
1. Загальні відомості про молекулярні спектри
Енергетична будова молекул складніше, ніж атомів. Поряд з рухом електронів відбувається коливальний рух ядер і обертання молекули як цілого. Тому в будь-якому стаціонарному стані енергія молекули складається з електронної, коливальної й обертальної. Найбільший внесок вносить електронна енергія, найменший − обертальна. Обертання молекул проявляється тільки в газоподібному стані, у конденсованих воно незначне.
Також, як і атом, молекула може існувати тільки в певних енергетичних станах, які називаються рівнями або молекулярними орбіталями. Кожному електронному рівню відповідають коливальні рівні, а кожний коливальному − обертальні, тобто будь-який електронний рівень описується головними, побічними, магнітними, спіновими, коливальними й обертальним квантовими числами.
При одержанні енергії або її втраті молекула переходить у новий енергетичний стан. Найбільш збудливими є зовнішні електрони (як і в атомах). Енергія їх збудження приблизно 150-600 кДж/моль, що відповідає видимій та УФ частинам спектра. Переходи між коливальними рівнями в межах одного електронного стану відповідають меншим енергіям (0,4−150 кДж/моль, випромінювання в ІЧ-області). Ще менші енергії мають переходи на обертальних рівнях (0,01 − 0,4 кДж/моль, випромінювання в далекої ІЧ- і мікрохвильовий областях). Переходи на цих рівнях називаються електронними, коливальними й обертальними. Чисто електронних спектрів не буває, тому що електронний перехід завжди супроводжується зміною коливального й обертального станів.
У молекулярній спектроскопії для збудження використовують електромагнітне поле. Сукупність всіх поглинених частот становить спектр поглинання (молекулярний абсорбційний спектр). Число енергетичних станів молекул дуже велико, а енергії окремих переходів дуже близькі, тому спектральні лінії зливаються в одну розмиту смугу поглинання. Максимум смуги відповідає лінії з найбільшою інтенсивністю.
Р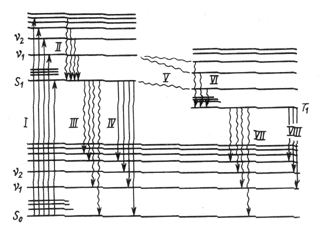 ис.1.
Енергетичні переходи в молекулі
ис.1.
Енергетичні переходи в молекулі
Повернення молекули від збудженого стану в основне відбувається складніше, ніж в атомах (мал. 1). Спочатку за короткий час молекула переходить на основний рівень збудженого стану S1, при цьому надлишкова енергія виділяється у вигляді теплоти (процес ІІ). Далі процес може відбуватися по одному із трьох шляхів: перехід без випромінювання з виділенням теплоти при зіткненні молекул з іншими частками (процес ІІІ); перехід на один з коливальних рівнів незбудженого стану з випущенням фотона (процес ІV, флуоресценція), перехід на триплетний збуджений рівень Т1 (процес (V), з якого можливий перехід у стан S0 з виділенням теплоти (процес VІІ) або фотона (процес VІІІ, фосфоресценція).
Не всі енергетичні переходи равноймовірні. Заборони на переходи такі ж самі, як і в атомній спектроскопії, але в молекулярних переходах вони можуть дотримуватися не строго.
Методи молекулярної спектроскопії розрізняються походженням аналітичного сигналу.
Абсорбційна молекулярна спектроскопія заснована на енергетичних переходах валентних електронів, сигнали яких проявляються у видимій і УФ-областях. Ці методи називають спектрофотометричними та фотометричними (колориметричними).
В ІЧ- спектроскопії реєструють коливальні переходи. Цей метод широко використовується для досліджень будови молекул та ідентифікації сполук.
Люмінесцентна спектрометрія базується на реєстрації випущенного випромінювання після повернення молекул в основний стан.
