
- •Реферат.
- •Введение.
- •Технология производства зефира «Ванильный»
- •Рецептура зефира.
- •Органолептические и физико-химические показатели пастилы и зефира.
- •Основное сырьё для производства зефира.
- •Отсадка зефира.
- •Описание операторной модели производства зефира.
- •Машинно-аппаратурная схема производства зефира
- •Описание машинно-аппаратурной схемы
- •Основные физико-химические процессы, протекающие при производстве зефира «Ванильный»
- •4.1. Пенообразование.
- •Студнеобразование.
- •Основные выводы.
-
Студнеобразование.
До сих пор механизм студнеобразования пектиновых веществ рассматривается в специальной литературе как процесс коагуляции коллоидных частиц. Неправильно объяснялась роль сахара и кислоты в этом процессе, а многие другие вопросы оставались не раскрытыми. В своей работе я попытаюсь объяснить механизм студнеобразования при получении мармеладо-желейных масс на основе теории ДЛФО.
В горячей фруктово-желейной массе студнеобразующее вещество находится в растворенном состояний. Его молекулы покрыты сольватными (гидратными) оболочками. Под действием теплового движения они беспорядочно перемещаются в дисперсионной среде, которой является водный раствор сахара, кислоты и экстрактивных веществ фруктово-ягодного пюре.
Карбоксильные группы пектиновых веществ способны диссоциировать на ионы, поэтому значительная часть молекул представляет собою высокомолекулярные анионы, так как несут на своей поверхности отрицательный заряд с величиной потенциала φ0. Вокруг пектиновых молекул возникает электрическое поле, которое притягивает из раствора катионы и отталкивает анионы. Следовательно, в водной оболочке, покрывающей пектиновые молекулы, образуется двойной электрический слой, толщиной 1/χ , где χ — величина обратная толщине ДЭС.
Агар и агароид в водном растворе также представляют собой электролиты. Они диссоциируют в воде на ионы кальция и высокомолекулярные анионы, отрицательный заряд которых определяется эфирносвязанными остатками серной кислоты.
Водные растворы студнеобразователей относятся к лиофильным дисперсным системам. Их лиофильность обусловлена тем, что на поверхности молекул пектиновых веществ, других студнеобразователей находится много полярных групп. Полярные вещества хорошо растворимы в таких полярных растворителях как вода. На их границах раздела возникает низкое межфазное натяжение, поэтому высокомолекулярные вещества, к которым относятся студнеобразователи, не обнаруживают значительной тенденции к ассоциации, поскольку агрегирование мицелл не сопровождается выигрышем энергии Гиббса. Это служит качественным обоснованием термодинамической устойчивости лиофильных систем. В таких дисперсионных системах тенденция к агрегированию практически отсутствует или настолько мала, что она преодолевается интенсивным тепловым движением частиц.
Чтобы вызвать агрегирование молекул студнеобразователя необходимо повысить межфазное натяжение на границе частица/вода. Это достигается присутствием в растворе сахара. Сахар повышает поверхностное натяжение водных растворов. Следовательно, чем больше концентрация сахара в дисперсионной среде, тем выше межфазное натяжение на границе макромолекул студнеобразователя с жидкой фазой, тем сильнее тенденция частиц дисперсной фазы к ассоциации и агрегированию.
Когда энергия взаимодействия молекул дисперсионной среды друг с другом значительно превосходит энергию их взаимодействия с веществом дисперсной фазы, среда будет способствовать сильному взаимному притяжению частиц дисперсной фазы.
Практикой установлено, что процесс студнеобразования пектиновых веществ при производстве мармелада протекает с достаточной скоростью, когда концентрация сахара соответствует насыщенному раствору при температуре 70°С. В таком растворе все молекулы воды связаны и удерживаются молекулами сахарозы. Сила этой связи значительно превосходит силу связи молекул воды с пектиновыми веществами, поэтому такая дисперсионная среда способствует агрегированию пектиновых веществ.
При добавлении сахара в раствор поверхностное натяжение дисперсионной среды повышается, увеличивается разность полярностей между средой и мицеллами студнеобразователя, что способствует их агрегированию. Полярность пектиновых молекул зависит от их строения. Чем выше степень этерификации молекулы, тем ниже ее сродство с водой и меньше полярность. Такие пектиновые вещества обладают большей склонностью к ассоциации, и следовательно, лучшей студнеобразующей способностью.
В достаточно концентрированных растворах, при температуре 70—75°С, в результате броуновского движения молекулы пектина могут сближаться и сталкиваться. На броуновское движение частиц в воде и других полярных средах с высокой диэлектрической проницаемостью влияют силы молекулярного, электростатического, гидродинамического и других взаимодействий. Энергия взаимодействия между мицеллами пропорциональна их размерам.
Влияние тех или иных сил зависит от расстояния между молекулами. При h→0 и h→∞ преобладают силы притяжения. В зависимости от расстояния h величина ван-дер-ваальсовых сил изменяется по уравнению
FM(h) = - A / (12πh2)
где А — константа Гаммакера.
На промежуточных расстояниях, при достаточно больших значениях φ0 и 1/χ преобладают силы электростатического отталкивания. Согласно теории ДЛФО их величина Fэл выражается уравнением
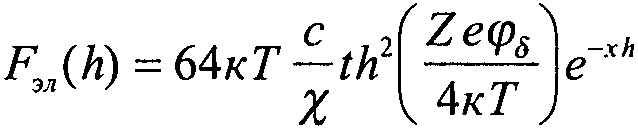
где С — концентрация электролита, моль/л; Z — валентность ионов, c—заряд электрона; φδ — потенциал диффузного слоя.
Результирующая энергия взаимодействия между мицеллами с учетом ван-дер-ваальсовых сил притяжения и ионноэлектростатического отталкивания может быть получена суммированием двух предыдущих выражений:
F(h) = FM(h) + Fэл(h)
Графическое изображение суммарной потенциальной энергии взаимодействия пектиновых мицелл по теории ДЛФО представлено на рисунке 6:
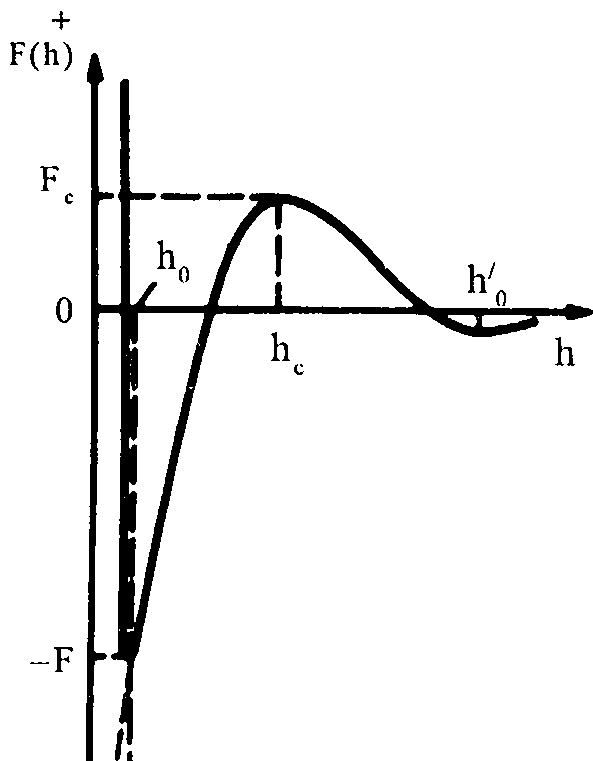
Рисунок 6. Кривая изменения потенциальной энергии взаимодействия между частицами в зависимости от расстояния.
Пектиновые вещества состоят из смеси веществ: пектина, пектовых и пектовой кислот, кроме того, отличаются по степени полимеризации молекул. В их молекулах может находиться большее или меньшее количество свободных карбоксильных групп, которые диссоциируют на ноны. Поэтому в растворе они представляют неодинаково заряженные мицеллы. Можно допустить присутствие и не заряженных частиц, Например, полностью этерифицированную молекулу пектина. Такие пектиновые мицеллы при сближении на расстояние h0 под действием сил притяжения коагулируют в дальней потенциальной яме.
При дальней коагуляции образуется коагуляционная структура с контактами через прослойку жидкой фазы. Она малопрочна, легко разрушается и тиксотропно восстанавливается, когда система находится в покое.
Скорость «дальней» коагуляции зависит от размера и концентрации пектиновых мицелл, заряда (или потенциала) поверхности частиц, концентрации электролита, кинетической энергии частиц, температуры дисперсионной среды, вязкости, гидродинамического сопротивления при сближении макромолекул.
Молекулы пектиновых веществ, несущие на своей поверхности электрический заряд, при сближении на расстояние, при котором происходит перекрытие их диффузных слоев, взаимоотталкиваются. Чтобы произошла коагуляция таких молекул, они должны за счет энергии теплового движения преодолеть энергетический барьер высотою Fc = F(hc). Если высота барьера значительно превышает среднюю энергию теплового движения пектиновых мицелл, то вероятность его преодоления и соответственно скорость коагуляции практически равны нулю.
При введении в дисперсионную среду индифферентного электролита, например, органической кислоты, без изменения заряда поверхности мицелл φ0, уменьшается толщина диффузного слоя 1/χ и его заряд φδ, что снижает энергию отталкивания. При определенных пороговых концентрациях электролита, которые тем меньше, чем больше валентность ионов, толщину диффузного слоя можно уменьшить до критического значения, при котором высота энергетического барьера становится равной нулю. Заряд диффузного слоя φδ существенно зависит от величины рН, и с понижением рН резко падает. При рН 3,5, φδ→0 (кривая 3).
Фактически процесс коагуляции модифицируется еще до полного исчезновения барьера, так как при небольшой его величине начинается просачивание молекул из дальней в ближнюю потенциальную яму, что приводит к необратимости коагуляции. При «дальней» коагуляции величина пороговой концентрации электролита С* логарифмически убывает с ростом числа частиц дисперсной фазы, а при необратимой «ближней» коагуляции эта зависимость отсутствует.
При высоких температурах дисперсионной среды, когда кинетическая энергия пектиновых молекул превосходит высоту энергетического барьера Fc и при сближении на расстояние h0 они попадают в поле значительных сил притяжения. Силы притяжения между молекулами на расстоянии h0 на два порядка выше сил притяжения в дальней потенциальной яме, поэтому жидкая прослойка между молекулами вытесняется и происходит непосредственный контакт по оголенным участкам, что и обусловливает прочность и эластичность студня.
Таким образом, регулируя высоту энергетического барьера добавлением в систему электролита, можно управлять скоростью коагуляции пектиновых молекул и получать студни с заданными физическими свойствами. При полном исчезновении энергетического барьера каждое столкновение молекул сопровождается их сцеплением, что отвечает порогу «быстрой» коагуляции. Благодаря тому, что макромолекулы имеют значительную длину и гибкость и могут входить в состав различных ассоциатов, в растворе образуется пространственная сетка. Образование студня есть не что иное, как процесс появления и постепенного упрочнения в застудневающей системе пространственной сетки. Для застудневания растворов высокомолекулярных веществ характерно, что связи образуются не по концам отдельных молекул, как это происходит при коагуляции коллоидных частиц, а могут возникать между любыми участками гибких макромолекул, лишь бы на них имелись группы, которые могут взаимодействовать друг с другом.
После образования пространственной сетки из ассоциированных молекул процесс застудневания происходит в результате возникновения между ними гомеополярных, гетерополярных и ассоциационных (вторично валентных) связей. Особенно большую роль для образования студня из гидрофильных веществ, к которым относятся пектины, агар, агароид и другие, играет водородная связь, возникающая между участками молекул, содержащих полярные группы (—СООН, —ОН). Вокруг них имеется значительное силовое поле, благодаря которому полярные группы связываются посредством вторичных валентностей:
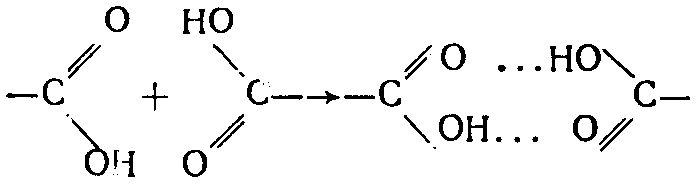
Подобные связи могут образовываться между полярными группами молекул полимера и полярными группами других веществ (вода, сахар и др.). Причем такие связи могут возникать между любыми участками гибких макромолекул, лишь бы на них имелись полярные группы по следующей схеме:
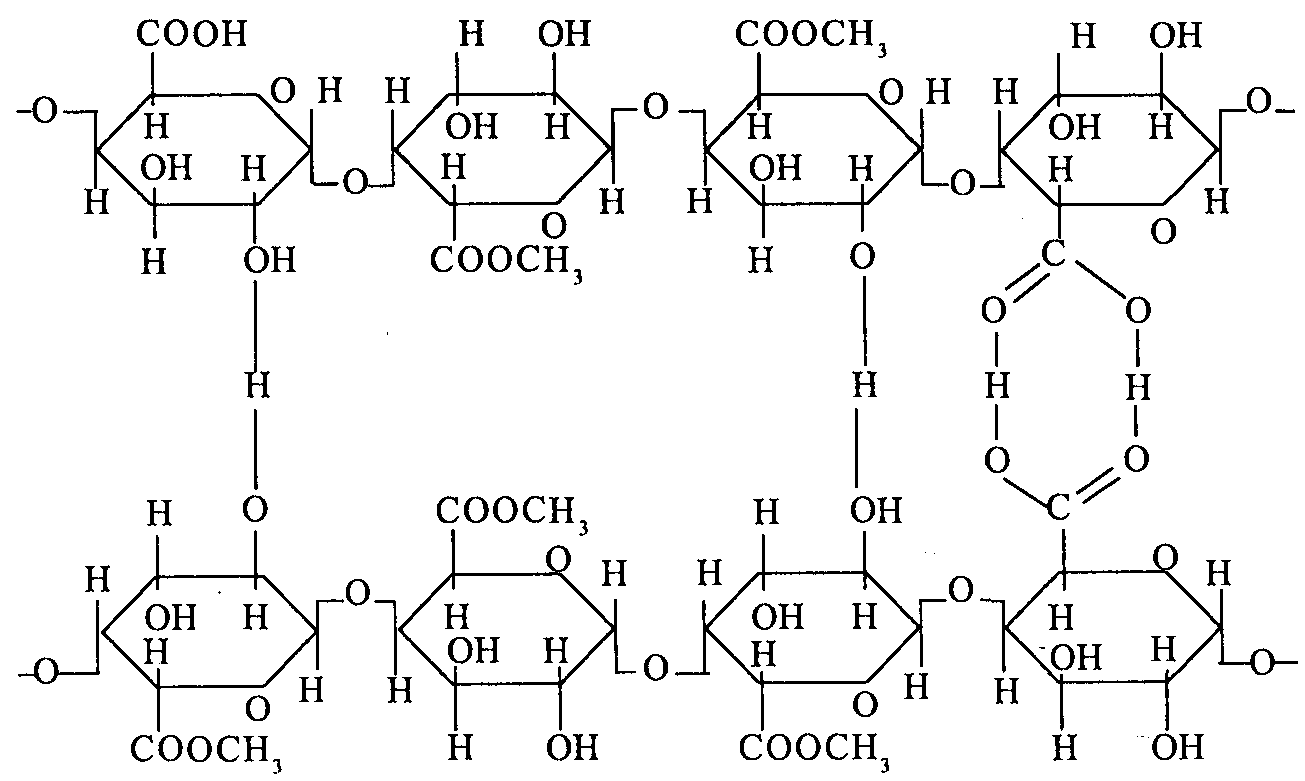
В образовании студня высокоэтерифицированных пектиновых веществ участвуют, кроме ассоциированных, гомеополярные связи между карбонильными и этерифицированными карбоксильными группами отдельных цепочек по схеме:
RCOOCH3 + HOR' → RCOO R' + CH3HO
Уменьшение степени этерификации молекул увеличивает электростатическое отталкивание. Для агрегирования таких пектиновых веществ в раствор необходимо ввести дополнительное количество кислоты или соли кальция. Степень этерификации, равная 50%, является границей, которая разделает пектиновые вещества по их влиянию кальций-ионов на образование студня.
Для ассоциации пектиновых молекул с низкой степенью этерификации требуется меньше сахара и кислоты, но обязательно присутствие в растворе ионов Са++ или Мg++. Адсорбция потенциал определяющих ионов снижает заряд на поверхности макромицелл, что существенно уменьшает энергетический барьер и способствует агрегированию молекул.
В результате отмеченных выше взаимодействий между пектиновыми молекулами образуется ячеистая структура, пронизывающая всю массу. Свободное пространство структурного каркаса заполняется дисперсионной средой, которая адсорбционно связывается с сеткой каркаса и отвердевает вместе с дисперсной фазой в одну сплошную массу без видимого разделения обеих фаз. Однако связь не прочна и при известных условиях жидкую фазу можно отделить (например, центрифугированием).
После сформирования студня происходит постепенное упрочнение пространственной сетки за счет взаимодействия полярных групп макромолекул, ионизирующих групп, несущих электрический заряд различного знака. При этом происходит упорядочение отдельных участков молекул. Эти участки обычно ориентируются параллельно друг другу, так как такое расположение способствует уменьшению свободной энергии системы.
Студнеобразующая способность агароподобных веществ зависит от их природы, молекулярной массы, строения молекулы и условий для образования студней - температуры, рН среды, ее состава и др.
Молекулярная масса пектина в 5 раз выше, чем у агара, и в 20 раз больше, чем у агароида. Сравнивая строение молекул этих веществ, нетрудно видеть, что в молекулах агара и агароида отсутствуют карбоксильные группы СООН, метильные группы ОСН3, столь характерные для пектиновой молекулы. В молекуле агара (а возможно и агароида) присутствует сульфатная группа НSО4. Значит, величина потенциала на поверхности молекул агара и агароида в растворе будет значительно ниже, чем на поверхности молекул пектина. Соответственно будет небольшой толщина диффузного слоя. Эти характеристики высокомолекулярных ионов, как отмечено выше, определяют величину сил электростатического отталкивания при ассоциации молекул.
По функциональным группам молекул можно также заключить, что молекулы агароподобных веществ менее полярны, чем молекулы пектина, поэтому их агрегирование может протекать и при небольших количествах сахара в жидкой фазе. Даже при небольшой концентрации ионов водорода или потенциализменяющих ионов обеспечиваются условия безбарьерной коагуляции.
Таким образом, механизм студнеобразования агароподобных веществ аналогичен рассмотренному выше для пектиновых веществ. Видимо, в данном случае больше преобладает нейтрализационная коагуляция, когда энергетический барьер подавляется адсорбцией потенциалопределяющих ионов.
Такая точка зрения подкрепляется результатами исследований, в которых отмечается, что наиболее важной характеристикой агаровых и агароидных студней, определяющей их физико-химические и структурно-механические свойства, являются величина заряда высокомолекулярного аниона, который обусловлен числом сульфатных групп в единице массы студнеобразователя и природой катиона.
Вводя в молекулу агара или агароида тот или иной катион, можно заранее в заданном направлении изменять величину заряда высокомолекулярного аниона, а следовательно, и физико-химические свойства студнеобразователя.
Добавление к агароидным растворам электролитов 0,01н концентрации повышает прочность студня. По силе действия электролиты располагаются в следующем порядке:
КСl > Аl2(SO4)3 > К2SO4 > ВаСl2 > NН4С1 > СаСl2 > NаСl.
Можно произвести замещение катионов в молекуле агара (агароида) и таким образом изменить их физико-химические свойства. Оказалось, что с увеличением электролитической диссоциации катиона замещенных образцов агароида увеличивается их вязкость в разбавленных растворах и степень набухания в воде, но при этом уменьшается способность к студнеобразованию. По способности диссоциации катионозамещенные образцы агароида располагаются в ряд:
Li > Nа > К > исходный > Са > Ва-агароид.
Наибольшей студнеобразующей способностью обладают катионозамещенные образцы Ва-агароида и Са-агароида.
Установлено положительное влияние солей NаНРО4 и NаC3H5O3 на прочность агароидного студня в количестве не выше 0,23—0,3% по массе студня.
При подкислении агароидных желейных масс снижается концентрация потенциалопределяющих ионов ОН, что является причиной снижения студнеобразующей способности. Прежнее толкование о гидролизующем действии кислоты на молекулу агароподобных веществ необходимо признать ошибочным. В присутствии ионов водорода агаровая молекула не может присоединять молекулы воды и распадаться на отдельные молекулы галактозы.
Способность агара и агароида к студнеобразованию зависит также от их природы и условий приготовления студней - температуры, реакции среды, ее состава и др.
