
Магнію сульфат
Мagnesii sulfas
MgSO4 . 7H2O M.M. 246,50
 Магнію сульфат
як лікарський засіб вперше став
застосовуватись в Англії, де його
добували з вод мінеральних джерел. На
відміну від інших препаратів магнію
сульфат має гірко-солоний смак, звідси
його назва гірка або англійська сіль.
Магнію сульфат
як лікарський засіб вперше став
застосовуватись в Англії, де його
добували з вод мінеральних джерел. На
відміну від інших препаратів магнію
сульфат має гірко-солоний смак, звідси
його назва гірка або англійська сіль.
Магнію сульфат широко розповсюджений у природі у вигляді кизериту MgSO4.H2O2.( MgSO4.7H2O), що є постійним супутником кам’яної солі. У великій кількості магнію сульфат знаходиться у морській воді. Отримують магнію сульфат із магнезиту MgCO3, обробляючи його сірчаною кислотою:
MgCO3 + H2SO4 = MgSO4 + CO2 + H2O
По зовнішньому вигляду препарат являє собою безколірні призматичні кристали, що вивітрюються на повітрі. Добре розчиняється у воді, практично нерозчинний у спирті.
Ідентичність:
Ідентичність препарату визначається по катіону магнію Mg2+ та аніону SO42-:
-
Утворення осаду білого кольору подвійного фосфату аммонію і магнію при взаємодії препарату з розчином двохзаміщеного натрію фосфату в аміачному розчині в присутності амонію хлориду
M gSO4
+
Na2HPO4
+ NH4OH
= MgNH4HPO4
+Na2SO4
+
H2O
gSO4
+
Na2HPO4
+ NH4OH
= MgNH4HPO4
+Na2SO4
+
H2O
-
Реакція з 8-оксихіноліном в присутності аміачного розчину та амонію хлориду, в результаті якої утворюється оксихінолят магнію, забарвлений у зеленувато-жовтий колір:
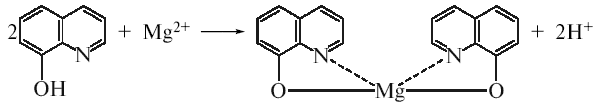
-
Аніон SO42- відкривається реакцією з розчином барію хлориду – випадає білий осад сульфату барію
MgSO4 +BaCL2 = BaSO4 + MgCL2
К ількісне
визначення:
ількісне
визначення:
Комплексонометрія, титрують 0,1М розчином едетату натрію в присутності аміачного буферного розчину (для підтримання сталим рН середовища), індикатор кислотний хром чорний спеціальний або кальконкарбонова кислота, титрують до синього забарвлення:

Магнію сульфат застосовується в медицині як послаблюючий засіб по 15-30 г на прийом всередину.
При парентеральному застосуванні діє на центральну нервову систему як заспокійливий засіб, як спазмолітик 25% розчин, як жовчогінний засіб 20-25% всередину.
Кальцію хлорид
Calcii chloridum
CaCl2. 6H2O M.M. 219,08

Кальцію хлорид для медичних цілей отримують обробкою карбонату кальцію (мармур, крейда, вапняк) хлороводневою кислотою:
C aCO3
+
2HCL
= CaCL2
+ CO2
+ H2O
aCO3
+
2HCL
= CaCL2
+ CO2
+ H2O
Фармакопейний препарат кальцію хлориду це безколірні призматичні кристали або білий кристалічний порошок без запаху гірко-солоного смаку, дуже легко розчинний у воді, викликає охолодження розчину, легко розчинний у спирті.
Препарат дуже гігроскопічний і на повітрі розпливається. Висока гігроскопічність препарату і здатність його розпливатись під дією вологи роблять склад цієї солі нестійким, що може призвести до неточного виготовлення лікарських форм. Тому в аптеках при отриманні субстанції готують 50% розчин кальцію хлориду у вигляді концентрату, а вже з нього готують ліки.
Ідентичність:
Ідентичність препарату визначається по катіону кальцію Ca2+ та аніону CL-:
-
Дуже чутливою є реакція з оксалатом амонію, утворений білий осад розчиняється у мінеральних кислотах і нерозчинний у оцтовій кислоті:
 (NH4)C2O4
+CaCL2
=
CaC2O4
+
2NH4CL
(NH4)C2O4
+CaCL2
=
CaC2O4
+
2NH4CL
-
Утворення білого осаду при взаємодії препарату з сульфатною кислотою розведеною або із сульфатами лужних металів:
C aCL2
+
H2SO4
=
CaSO4
+2HCL
aCL2
+
H2SO4
=
CaSO4
+2HCL
Осад сульфату кальцію розчиняється у сульфаті амонію з утворенням безколірного комплексу.
-
Солі кальцію забарвлюють полум’я у цегляно- червоний колір.
-
З гліоксальгідроксианілом в присутності натрію гідроокису, натрію карбонату та хлороформу. Хлороформний шар при струшуванні набуває червоного кольору:
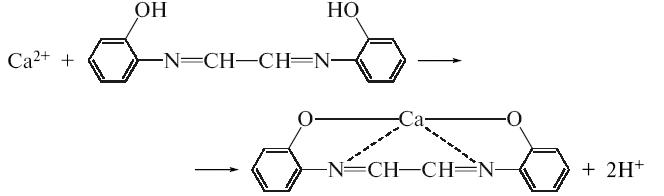
-
Утворення білого сирнистого осаду при взаємодії препарату з розчином срібла нітрату:
2AgNO3 + CaCL2 = 2AgCL + Ca(NO3)2
Білий осад
К ількісне
визначення:1.Комплексонометрія,
титрують 0,1М розчином едетату натрію в
присутності аміачного буферного розчину
(для підтримання сталим рН середовища),
індикатор кислотний хром чорний
спеціальний, титрують до синього
забарвлення.
ількісне
визначення:1.Комплексонометрія,
титрують 0,1М розчином едетату натрію в
присутності аміачного буферного розчину
(для підтримання сталим рН середовища),
індикатор кислотний хром чорний
спеціальний, титрують до синього
забарвлення.
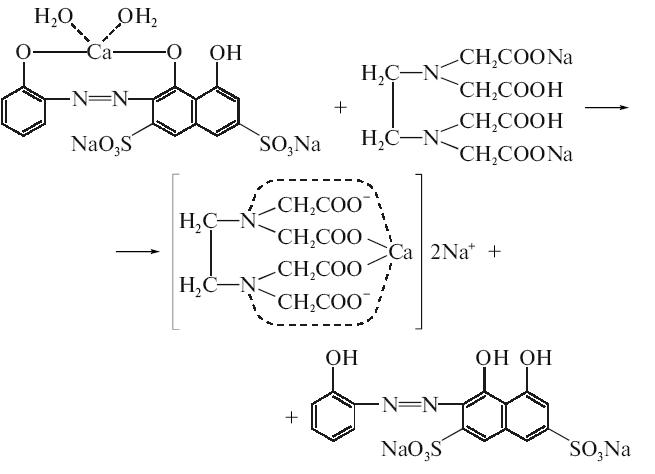
2.Аргентометрія, метод Мора, індикатор калію хромат, титруємо до появи цегляно-червоного забарвлення:
2AgNO3 + CaCL2 = 2AgCL + Ca(NO3)2
AgNO3 + K2CrO4 =Ag2CrO4 + 2KNO3
-
Аргентометрія, метод Фольгарда, індикатор залізо-амонійні галуни. До наважки препарату додають точний надлишок титрованого розчину срібла нітрату, ЗАГ, надлишок срібла нітрату відтитровують амонію тіоціанатом до появи червоного забарвлення.
2AgNO3 + CaCL2 = 2AgCL + Ca(NO3)2
Білий осад
![]()
![]()
Кальцію
хлорид застосовується як кровоспинний
засіб при легеневих, шлунково-кишкових,
носових та маточних кровотечах, для
підвищення з гортання
крові, при алергічних захворюваннях,
при отруєннях солями магнію.
гортання
крові, при алергічних захворюваннях,
при отруєннях солями магнію.
Назначають всередину 5-10% розчини, внутрішньовенно по 5-10 мл 10% розчину, входить до складу розчину Рінгера.
