
Фактори стабільності натрію гідрокарбонату у водних розчинах:
-
обов’язково використовувати натрію гідрокарбонат кваліфікації „для ін’єкцій”, „х.ч.”, або „ч.д.а.”;
-
розчин потрібно готовити у воді кімнатної температури;
Флакони заповнюються розчином на 2/3 його об’єму, щоб у флаконі завжди було місце для газу, що вивільнюється при стерилізації. Не допускається приготування розчинів у склянках з притертим корком. Слід пам’ятати, що
під час стерилізації у розчині протікає реакція:
2NaHCO3 = Na2CO3 + H2O+ CO2
-
П
 ісля
охолодження розчину рівновага в системі
при наявності вуглекислоти, знову
зміщується ліворуч, тому розчин
використовують тільки через 2 години
після стерилізації. Вивантаження
простерилізованих флаконів із автоклава
слід проводити через 20-30 хв. після того,
як тиск в камері досягає нуля. Розчин
повинен бути прозорим і безбарвним.
ісля
охолодження розчину рівновага в системі
при наявності вуглекислоти, знову
зміщується ліворуч, тому розчин
використовують тільки через 2 години
після стерилізації. Вивантаження
простерилізованих флаконів із автоклава
слід проводити через 20-30 хв. після того,
як тиск в камері досягає нуля. Розчин
повинен бути прозорим і безбарвним. -
Використовують розчин натрію гідрокарбонату після повного охолодження. Для розчинення виділеного вуглецю діоксиду (CO2) флакони декілька разів плавно перевертають „вверх дном”.
Застосовують всередину, внутрішньовенно, 1, 3, 4% розчини, у свічках по 0,3, 0,5 г, місцево 0,5-2% розчини.
Зберігають порошок в добре закупореній тарі ,свічки в сухому, захищеному від світла місці.

Лекція №6
Тема: Лікарські засоби неорганічної природи. Ш група періодичної системи. Лікарські засоби сполук Бору. ІІ група періодичної системи. Лікарські засоби сполук Магнію, Кальцію, Цинку.
План:
-
Загальна характеристика групи.
-
Кислота борна.
-
Натрію тетраборат.
-
Магнію сульфат.
-
Кальцію хлорид.
-
Цинку сульфат.

До Ш групи періодичної системи належать п’ять елементів: бор, алюміній, галій, індій і талій. Елементи Ш групи характеризуються наявністю на зовнішній електронній оболонці 3 електронів. З ростом атомної маси зростають металічні властивості елементів. У бору переважають неметалічні властивості; гідроксиди алюмінію, галію і талію амфотерні. З ростом атомної ваги зростає також і токсичність сполук елементів Ш групи, і тому препарати талію належать до отрут.
Сполуки галію і індію не знайшли жодного застосування в лікарській справі.
 Бор розповсюджений
у природі елемент. Він входить до складу
багатьох мінералів у вигляді кисневих
сполук.
Бор розповсюджений
у природі елемент. Він входить до складу
багатьох мінералів у вигляді кисневих
сполук.
Найважливішими мінералами бору є бура
Na2B4O7 . H2O (тинкаль), борокальцит CaB4O7.4H2O.
 Мінерали
алюмінію широко розповсюджені у природі.
Мінерали
алюмінію широко розповсюджені у природі.
З них найважливішими є біла глина 2SiO2 . AL2O3 . 2H2O, кріоліт Na3ALF6. Вихідною сировиною для виготовлення лікарських засобів є тільки біла глина.
Солі алюмінию легко гідролізуються в водних розчинах з утворенням колоїдного гідроксиду. В зв’язку з цим вони мають обволікаючу, адсорбуючу та в’яжучу дію.
Сполуки бору Кислота борна
Аcidum boricum
H3BO3 M.M. 61,83
 Борну
кислоту отримують із бури, обробляючи
її гарячий розчин мінеральною кислотою:
Борну
кислоту отримують із бури, обробляючи
її гарячий розчин мінеральною кислотою:
Na2B4O7 + H2SO4 + 5H2O = Na2 SO4 + 4H3BO3
Властивості:
Б орна
кислота – безбарвні блискучі лусочки
або дрібний кристалічний порошок,
розчинний в 25 ч. води холодної, в 3,5 ч.
води гарячої, в 25 ч. спирту та 5 ч. гліцерину.
Водні розчини мають слабокислу реакцію,
але солі борної кислоти невідомі. При
нейтралізації кислоти утворюються
тетраборати (солі кислоти H2B4O7)
або метаборати
(солі
кислоти HBO2).
При додаванні до розчину борної кислоти
гліцерину або маніту (згідно ДФУ)
появляється сильнокисла реакція в
результаті утворення одноосновної
гліцероборної кислоти:
орна
кислота – безбарвні блискучі лусочки
або дрібний кристалічний порошок,
розчинний в 25 ч. води холодної, в 3,5 ч.
води гарячої, в 25 ч. спирту та 5 ч. гліцерину.
Водні розчини мають слабокислу реакцію,
але солі борної кислоти невідомі. При
нейтралізації кислоти утворюються
тетраборати (солі кислоти H2B4O7)
або метаборати
(солі
кислоти HBO2).
При додаванні до розчину борної кислоти
гліцерину або маніту (згідно ДФУ)
появляється сильнокисла реакція в
результаті утворення одноосновної
гліцероборної кислоти:
CH2OH-CHOH-CH2OH + H3BO3 = CH2OH- B(CHO-CH2O)OH + 2 H2O
Ідентичність:
-
Характерною реакцією на борну кислоту є горіння її спиртових розчинів зеленим полум’ям. При цьому утворюється борноетиловий ефір:
H3BO3 + 3C2H5OH = B(OC2H5)3 + 3H2O
H 3BO3
+
3CH3OH
= B(OCH3)3
+ 3H2O
(згідно
ДФУ)
3BO3
+
3CH3OH
= B(OCH3)3
+ 3H2O
(згідно
ДФУ)
Реакція проходить найкраще при наявності концентрованої сірчаної кислоти, яка зміщує реакцію вправо.
-
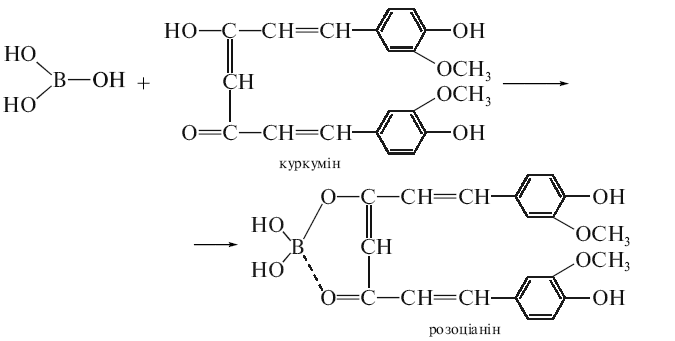
Куркумовий папірець, змочений розчином борної кислоти та декількома краплями хлороводневої кислоти, забарвлюється при висушуванні в рожевий або червоно-бурий колір, що переходить від розчину аміаку в зелено-чорний.
Кількісне визначення:
Метод нейтралізації, алкаліметрія, титрований розчин 0,1М гідроксиду натрію, в присутності гліцерину або маніту, індикатор фенолфталеїн, титрування проводять до появи рожевого забарвлення:
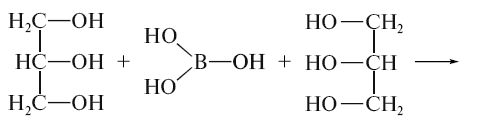
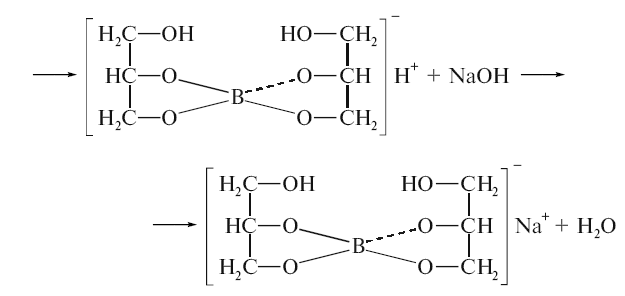
Борна кислота використовується як антисептичний засіб, у вигляді 2-3% водних розчинів для полоскання горла, в мазях та присипках. 1-2% розчини застосовуються в очній практиці.
