
Натрію тетраборат. Бура.
Natrii tetraboras. Borax.
Na2B4O7 . H2O M.M. 381,37
В природі натрію тетраборат зустрічається у вільному стані у вигляді мінералу тинкалю, препарат отримують кристалізацією з води. Крім того, препарат одержують з борокальцитів, кип’ятять з розчином соди, відфільтровують утворений кальцій карбонат:
CaB4O7 + Na2CO3 = Ca CO3 + Na2 B4O7
З холодного фільтрату викристалізовують буру.
Властивості:
Натрію тетраборат- безбарвні прозорі кристали або білий кристалічний порошок, розчинний в 25 ч. холодної та 0,5 ч. гарячої води. В спирті не розчиняється. Водні розчини мають внаслідок гідролізу слаболужну реакцію. Проте при додаванні до водного розчину бури гліцерину реакція стає кислою внаслідок утворення гліцероборної кислоти:
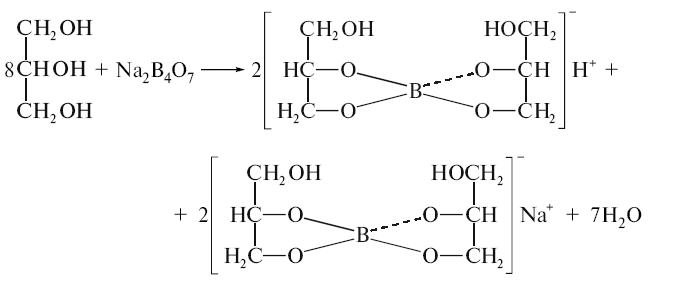
При нагріванні до 75º топиться в своїй кристалізаційній воді.
І дентичність:
дентичність:
-
При внесенні крупинки бури в полум’я воно забарвлюється в жовтий колір (іон натрію);
-
До розчину препарату додають 15% розчин K2CO3, нагрівають до кипіння, додають 4 мл розчину калію піроантимонату, знову доводять до кипіння, охолоджують у льодяній воді, при необхідності потирають стінки пробірки скляною паличкою, утворюється густий білий осад. (іон натрію):

-
З метоксифенілоцтовою кислотою утворюється об’ємний білий кристалічний осад, що розчиняється у розчині аміаку (іон натрію):
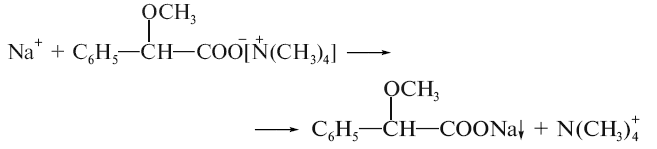
-
Характерною реакцією на бор є горіння її спиртових розчинів зеленим полум’ям. При цьому утворюється борноетиловий ефір.

Реакція проходить найкраще при наявності концентрованої сірчаної кислоти, яка зміщує реакцію вправо.
-
Куркумовий папірець, змочений розчином борної кислоти та декількома краплями хлороводневої кислоти, забарвлюється при висушуванні в рожевий або червоно-бурий колір, що переходить від розчину аміаку в зелено-чорний.
Кількісне визначення:
1.Метод нейтралізації, ацидиметрія, титрований розчин 0,1М хлороводнева кислота, індикатор метиловий оранжевий, що має інтервал переходу забарвлення 3,0 (червоний) – 4,4(жовтий ). Титрування проводять до переходу забарвлення від жовтого до рожевого.
Na2B4O7 +2HCL = 4 H3BO3 + 2 NaCL
2. Алкаліметрія гліцеринових розчинів s= 1/2
Використовується як антисептичний засіб для спринцювання, полоскань і змазувань.
Зберігають препарат в умовах, що виключають звітрювання води.
Атоми елементів другої групи періодичної системи мають на зовнішній електронній оболонці 2 електрони, віддалені від ядра на значну відстань. Тому вони легко відщіпляються від атомів, які перетворюються при цьому в позитивно заряджені двохзарядні іони. У другій групі існує дві підгрупи: головна, що включає лужноземельні метали (берилій, магній, кальций, стронцій, барій, радій) та побічна підгрупа, що включає елементи (цинк, кадмій, ртуть). Елементи головної підгрупи, крім берилію і радію, мають яскраво виражені металічні властивості. Лужноземельні метали є легкими металами і мають високу реакційну здатність. Металічні властивості побічної підгрупи слабшають від цинку до ртуті.
Найбільш токсичним із елементів другої групи періодичної системи є барій в своїх розчинних сполуках, які застосовуються лише як реактиви і яди для комах та гризунів. В медицині застосовується барію сульфат, практично нерозчинна ні в одному з розчинників сіль.
