
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
5.2. Некоторые основные биометаллы
Многие металлы, которые также входят в состав сложных органических соединений или комплексов, обладающих биологической активностью, являются компонентами белков. Хотя большинство металлов находятся в организме в следовых количествах, они участвуют в различных формах метаболизма, транспорте, синтезе, контроле, а также входят в состав ферментов и необходимы для роста костей. Металл либо является составной частью фермента, либо необходим как активатор фермента. Металл может функционировать как связующий мостик между ферментом и субстратом, находясь в соединении с обоими и удерживая таким образом субстрат около активного центра фермента. В некоторых случаях металл изменяет константу равновесия ферментативной реакции в благоприятную сторону.
Наиболее важными биометаллами являются как s-элементы (Na+,K+,Mg2+,Ca2+), так и d-элементы(Fe2+,Fe3+,Cu2+,Co2+,Zn2+ и др.). Натрий, кальций, магний и калий, образуя менее прочные комплексы, чем d- элементы, являются компонентами, поддерживающими нормальное осмотическое давление биологических жидкостей, создавая условия осмотического градиента между этими жидкостями и клетками, оказывая регулирующее влияние на те или иные ферменты и принимая участие в превращениях белков. В частности, ионы щелочных металлов Na+ и K+ в метаболических процессах образуют координационные соединения с участием макроциклических лигандов. В тканях млекопитающих действует система транспорта ионов калия и натрия (натриевый насос), обеспечивающий необходимое соотношение ионов Na+ и K+ во внеклеточном и внутриклеточном пространстве. Установлено, что ионы калия проникают в клетки против градиента концентрации с помощью фосфатопротеина, который образует с ионами K+ более прочные комплексы (в силу соответствия размеров иона K+ и полости ионофора), чем с ионами Na+. В составе комплекса с фосфатопротеином ион калия проходит через клеточную мембрану. Во внутриклеточном пространстве фосфатопротеин взаимодействует с аденозинтрифосфатом, который образует более прочное соединение с ионами натрия, чем с ионами калия, и выводит ионы Na+ из клетки во внеклеточное пространство.
Железо относится к группк жизненно необходимых элементов. Общее содержание железа в теле человека составляет
~10-2%. Железо, находящееся в организме человека, можно подразделить на две большие группы: клеточное и внеклеточное. Внутриклеточные соединения железа подразделяют на 4 подгруппы:1) гемопротеиды, основным структурным элементом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза и пероксидаза); 2) железосодержащие ферменты негеминовой группы (сукцинатдегидрогеназа, ацетилкоэнзим А-дегидрогеназа, НАДФ-цитохром С редуктаза и др.); 3) ферритин и гемосидерин внутренних органов; 4) железо, рыхло связанное с белками и другими органическими веществами. К группе внеклеточных соединений железа относятся связывающие железо белки трансферрин и лактоферрин, содержащиеся во внеклеточных жидкостях.
Гем
- комплекс протопорфирина с железом
является важнейшим хелатным комплексом
железа(II)
(рис.42):
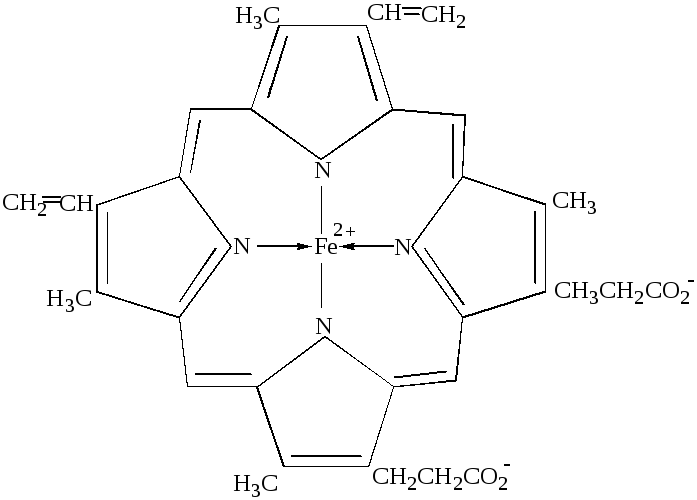
Рис. 42. Гем.
Этот комплекс является простетической группой гемопротеинов, к которым относятся кислородпереносящие белки (гемоглобин, миоглобин, цитохромы) и некоторые ферменты (каталаза, цитохромоксидаза). В геме четыре атома азота пиррольных колец образуют плоский квадрат, в центре которого находится железо. Гемовая группа присоединяется к белковой части молекулы гемоглобина и миоглобина путём координации гистидинового атома азота белка ионом железа гемовой группы (рис.43 ):
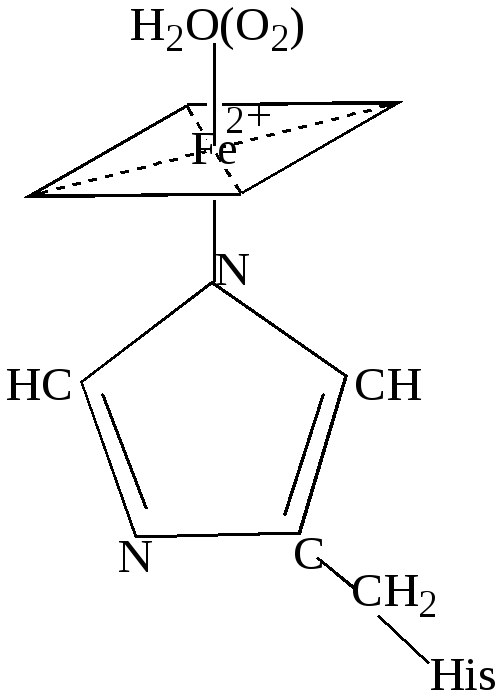
Рис.43. Схема связи гема с молекулой белка.
Следовательно, в координационную сферу ионов железа входит пять атомов азота (четыре атома азота порфирина, один атом азота белкового гистидина). В отсутствие кислорода шестым лигандом является молекула воды, которая связывается с ионом Fe2+ по другую сторону порфиринового кольца и таким образом завершает построение октаэдрического комплекса. Гемоглобин – тетрамерный белок с молекулярной массой 64500. Он состоит из двух идентичных пар субъединиц (α и β), расположенных приблизительно в форме тетраэдра и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну гем-группу. Гемоглобин и миоглобин одинаково связывают кислород при высоком парциальном давлении кислорода, но при падении давления кислорода преимущество в связывании имеет миоглобин. В результате использования кислорода в тканях мышц происходит падение парциального давления кислорода, накопление в мышцах углекислого газа и, как следствие, понижение рН. Это ещё более способствует высвобождению кислорода из гемоглобина и передаче кислорода миоглобину. Когда гемоглобин переходит в дезоксигемоглобин вследствие потери кислорода, железо переходит в высокоспиновое состояние (КЧ=5). Ослабление связи с атомами азота порфирина приводит к выходу атома железа из плоскости кольца порфирина. При присоединении кислорода к гемоглобину образуется низкоспиновый октаэдрический комплекс, железо в котором находится в плоскости порфиринового кольца (КЧ=6). Степень окисления железа, содержащегося в гемоглобине, в процессе переноса кислорода не изменяется и всегда равна +2. Гемоглобин циркулирующих эритроцитов, содержащий около 80% общего количества железа, является основным фондом железа в организме позвоночных.
В крови человека кроме гемоглобина присутствуют и другие белковые гемсодержащие образования на основе железа, например, цитохромы, играющие роль переносчиков электронов. В цитохромах железо имеет координационное число 6. Так же как и в гемоглобине, железо находится в центре порфиринового кольца, но пятым и шестым лигандами служат атом азота гистидина и атом серы метионина, входящих в состав полипептидной цепи белковой части молекулы цитохрома., поэтому железо в цитохроме не связывает молекулярный кислород и роль его при катализе процессов окисления сопряжена с изменением его степени окисления: Fe(II) →Fe(III).
В крови железо переносится в форме комплекса с плазменным белком трансферрином. Трансферрин является транспортным белком, переносящим железо из обломков гемоглобина ретикулоэндотелиальных клеток селезёнки и печени в костный мозг, где на его специальных участках вновь синтезируется гемоглобин. Трансферрин – это гликопротеин с молекулярной массой около 80000. Он состоит из одной полипептидной цепи, свёрнутой так, что она образует два компактных участка, каждый из которых способен связать по одному иону железа (III). Но связывание железа возможно лишь при одновременном связывании аниона. В отсутствие подходящего аниона катион железа не присоединяется к трансферрину. В большинстве случаев в природе для этого используется карбонат.
В тканях железо в основном запасается в виде ферритина. Ферритин является водорастворимым белком, состоящим из 24 одинаковых субъединиц. Они составляют пустотелую сферическую оболочку с внешним диаметром около 12,5нм и диметром полости примерно 7,0нм. Во внутренней полости находится мицеллярное ядро из неорганического комплексного оксогидроксофосфата железа(III) состава (FeO.OH)8(FeO.OPO3H2).Содержание железа в мицелле примерно 57%. Белковую часть пронизывают шесть каналов диаметром около 1,0нм, которые служат для приёма и отдачи железа. Приём железа происходит при каталитическом окислении Fe(II) в Fe(III), а высвобождение – при восстановлении Fe(Ш) до Fe(II). Ферритин в больших количествах содержится в печени, селезёнке и костном мозгу.
Цитохромы – это соединения, принадлежащие к классу гемопротеинов, которые включены в электротранспортную цепь митохондрий и в которых перенос электрона связан с наличием окислительно-восстановительной пары железо(III) – железо(II). Каждый из цитохромов, расположенных в определённой последовательности в дыхательной цепи, находясь в форме [Fe(III)], присоединяет один электрон и переходит в форму [Fe(II)]. Лучше всего среди цитохромов изучен цитохром с. Цитохром с содержит гемогруппу, связанную с белком (мол. масса 12500) через тиоэфирные мостики.
Каталазы катализируют диспропорционирование пероксида водорода, образующегося при неполном восстановлении кислорода до воды и молекулярного кислорода. Каталаза – это фермент, имеющий молекулярную массу около 240000, сформирован из четырёх одинаковых субъединиц, каждая из которых содержит одну группу гема с высокоспиновым железом(III).
Медь является незаменимым микроэлементом, необходимым для нормальной жизнедеятельности человека, животных и растений. Входя в состав гормонов, медь влияет на рост, развитие, воспроизведение, обмен, фагоцитарную активность лейкоцитов. Соединения меди занимают второе после соединений железа место в качестве катализаторов окислительно-восстановительных процессов. Электронпереносящие простетические группы цитохромоксидазы наряду с железом содержат также медь, которая играет важную роль в каталитической активности этого фермента. Атомы меди в цитохромоксидазе подвергаются циклическим изменениям Cu(II) – Cu(I) и таким образом участвуют в переносе электронов, акцептором которых служит кислород. Белки животных и растительных организмов имеют высокое сродство к ионам меди. Главным медь- содержащим белком плазмы крови является церулоплазмин. Порфириновые соединения меди служат звеном при образовании гемоглобина. Медь входит в структуру эритроцитов и в состав нуклеопротеидных комплексов, играющих исключительную роль в синтезе гемоглобина. Медь, наряду с цинком входит в состав фермента супероксиддисмутазы, которая катализирует диспропорционирование супероксид-иона O2- до кислорода и пероксида водорода, который, в свою очередь, разлагается каталазой. Геометрия окружения меди – искажённая плоскоквадратная с четырьмя имидазольными лигандами от четырёх молекул гистидина. Ион цинка находится в тетраэдрическом окружении с тремя азотными донорами трёх молекул гистидина и одним кислородным донором от аспарагиновой кислоты. Одна молекула гистидина является общим для обоих металлов лигандов, и его имидазол оказывается поэтому мостиком (рис.44):

Рис.44. Связь между медью и цинком в супероксиддисмутазе.
Медь является компонентом аскорбиноксидазы, катализирующей окисление аскорбиновой кислоты. В свободном состоянии ионы меди обладают окислительным действием подобно оксидазе, каталазе и пероксидазе. Особенно высокая биологическая активность её как окислителя проявляется в соединении с белками.
Кобальт(III) входит в корриновую циклическую систему витамина В12, которая по химическому строению сходна с порфириновой циклической системой гема и гемопротеинов. Ион Со(III) связан с четырьмя лежащими в одной плоскости атомами азота пиррольных колец, а пятым и шестым лигандами служат цианид-ион и атом азота гетероцикла бензимидазола (рис.45). Витамин В12 необходим для нормального кроветворения.
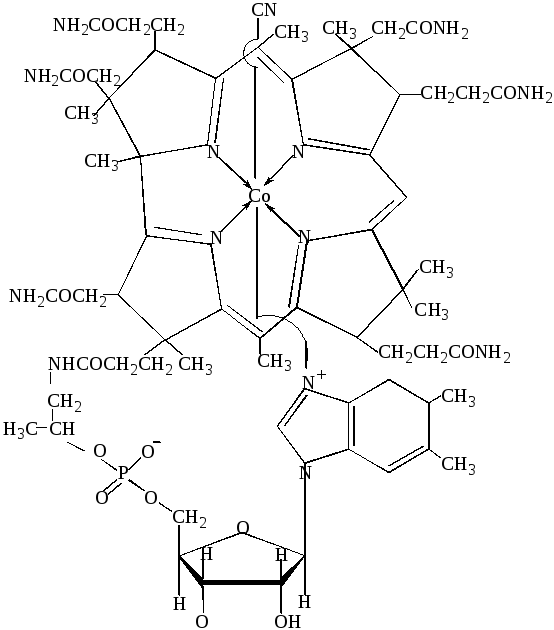
Рис.45. Витамин В12(цианкобаламин).
Гемопоэтическое действие кобальта эффективно, если в организме имеются достаточные запасы железа и меди. Металлоорганические комплексы кобальта являются мощным стимулятором гемопоэза. Влияние кобальта на организм не ограничивается только гемопоэзом. Он связан с деятельностью ферментов,витаминов,гормонов и оказывает влияние на белковый, жировой и углеводный обмен. Например, в глицилглицин-дипептидазе кобальт образует хелатное соединение с тремя группами фермента, в результате получается фермент-субстратный комплекс (рис.46 ):
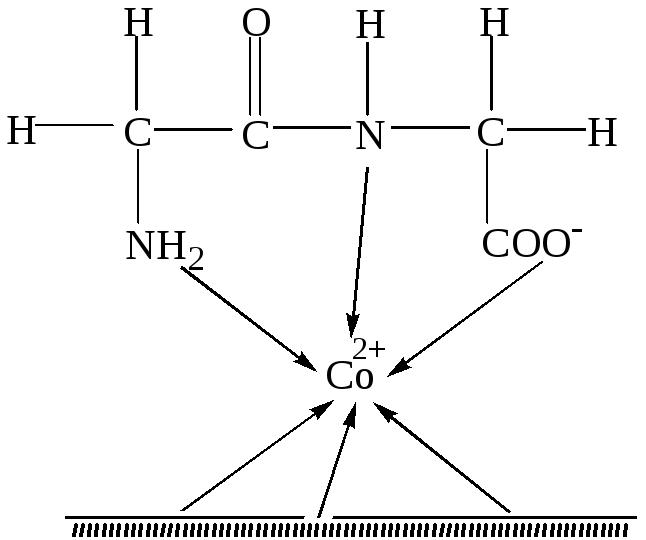
Рис.46. Схема фермент-субстратного комплекса глицилглицин-дипептидазы.
Данный фермент действует только на пептиды и не действует на эфиры аминокислот, поэтому на схеме показано, что во взаимодействии участвует NH-группа пептидной связи.
Цинк связан с ферментами, гормонами и витаминами. Таким образом, цинк значительно влияет на основные жизненные процессы: кроветворение, размножение, рост и развитие организма, обмен углеводов, белков и жиров, окислительно-восстановительные реакции, энергетический обмен. В крови цинк находится в виде комплексов с белками и лишь ничтожная часть в акваформе (менее 0,01%). Транспорт цинка в крови осуществляется в виде комплексов с α- и γ–глобулинами. Почти весь цинк в эритроцитах находится в составе карбоангидразы. Цинк, находящийся в органах и тканях, легко соединяется с аминокислотами, нуклеиновыми кислотами, пуриновыми основаниями и белками. Среди содержащих цинк белков большинство составляют ферменты. В организме человека содержится несколько десятков цинксодержащих ферментов, таких, как алкогольдегидрогеназа,ДНК- и РНК-полимеразы, карбоангидраза и карбоксипептидаза. Например, карбоангидраза, которая содержится в красных кровяных тельцах, примерно в миллион раз ускоряет реакцию:
СО2+ ОН- = НСО3- ( как прямую, так и обратную).Карбоангидраза состоит из больших белковых молекул с молекулярной массой 430000. В одной молекуле фермента содержится только один ион Zn2+, который находится вблизи центра полости карбоангидразы. Координационный полиэдр комплекса представляет собой искажённый тетраэдр. Три положения занимают донорные атомы азота из имидазольных групп гистидина, четвёртое координационное место занято молекулой H2O или ионом OH-. Установлено, что введение в координационную сферу иона Zn2+ таких лигандов, как ионы CN-, N3-, образующих более прочную связь ионом цинка, чем HCO3-,H2O или OH- , приводит к ингибированию синтеза и распада HCO3-, что приводит к нарушению нормального состояния организма.
Ион цинка в карбоксипептидазе, так же как в карбоангидразе, находится в полости активного центра фермента, но только два места в его координационной сфере заняты азотом имидазольных остатков гистидина. Третье координационное место занято кислородом глутамина, четвёртое место принадлежит молекуле воды. В карбоксипептидазе цинк образует хелатное соединение с двумя группами ферментов. Структура подобного фермент-субстратного комплекса представлена на рис.47. Предполагается, что ион цинка, координируя атом кислорода карбонила пептидной цепи, ослабляет связь C-N в пептидной цепи, что облегчает её разрыв, сопровождающийся гидролизом. Карбоксипептидаза действует на некоторые сложные эфиры со свободной концевой карбоксильной группой, и, следовательно, для её действия NH- группа не является необходимой. На схеме (рис.47) показано образование хелатной связи с кислородом карбонила.
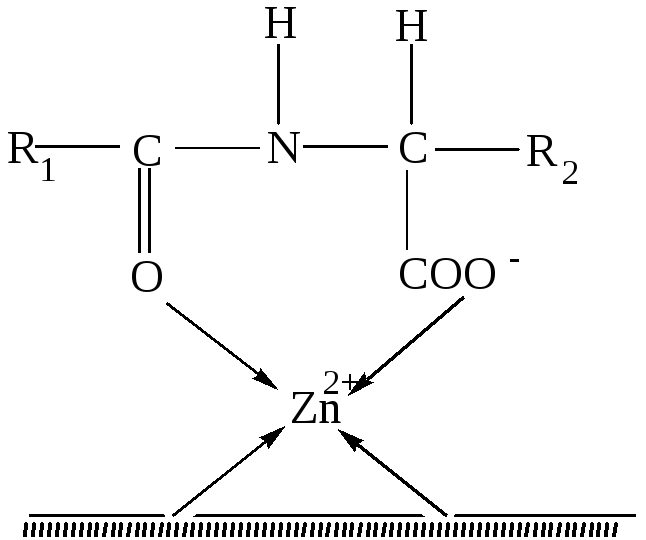
Рис.47.Схема фермент-субстратного комплекса
карбоксипептидазы.
Ряд нефлавопротеидных дегидрогеназ, в частности алькогольдегидрогеназа и глутаматдегидрогеназа, содержат цинк. Цинк входит как составная часть в структуре молекулы фермента. В каждом активном центре имеется один атом цинка. Вследствие этого число атомов цинка равно числу молекул НАД, связываемых молекулой фермента. Алкогольдегидрогеназа печени (молекулярная масса 84000) содержит 2 атома цинка и связывает 2 молекулы НАД. Удаление цинка вызывает как у алкогольдегидрогеназы, так и у глутаматдегидрогеназы не только инактивацию, но также диссоциацию белковой части фермента на субъединицы. Цинк, связываясь с донорными атомами азота, серы и кислорода НАД, соединений, которые служат субстратами ферментов, связывает субстраты с активным центром или белковые субъединицы друг с другом.
