
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
3.4.3. Стерические факторы
Чем меньше радиус иона-комплексообразователя, и чем выше его заряд, тем более прочные комплексы он образует. Так, для [Co(NH3)6]2+ lgβ6 =4,39 , а для [Co(NH3)6]3+ lgβ6=35,21.
Комплексный ион [Co(NH3)6]2+ обратимо распадается в воде:
[Co(NH3)6]2+ + 6H2O [Co(H2O)6]2+ + 6NH3 .В то же время комплексный ион [Co(NH3)6]3+ практически не разрушается водой.
Устойчивость комплексных соединений также зависит от пространственного окружения донорных атомов. Введение заместителей в положения, близкие к донорным атомам, может затруднить образование комплекса. Особенно сильно проявляются стерические затруднения в комплексах с хелатообразующими лигандами. Например, такой эффект наблюдается при использовании 2-алкилпроизводных 8-оксихинолина(HL):
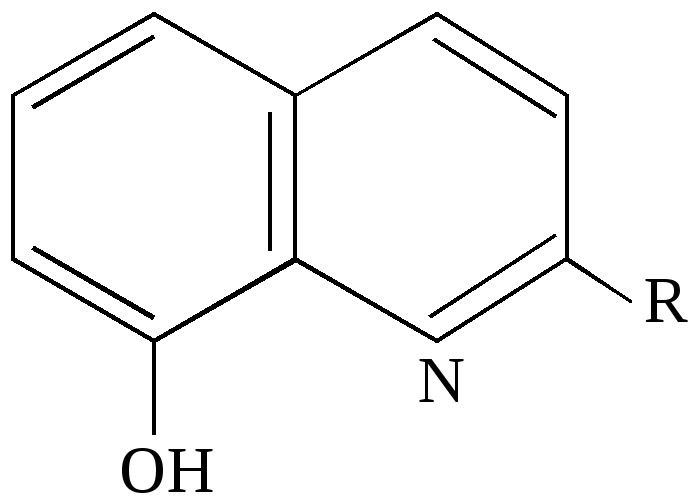
Он может образовывать с двухзарядными ионами внутрикомплексные соединения тетраэдрической конфигурации состава МL2 ,а с трёхзарядными - октаэдрические комплексы МL3 . Однако для ионов малого радиуса, в частности Al3+, образование комплексов ML3 невозможно ввиду стерических затруднений, создаваемых группой в положении 2. В этом случае образуются лишь заряженные, растворимые комплексы ML2+и ML2+. На этом основано применение в аналитической химии 2-замещённых
8-оксихинолинов для осаждения ионов Cr3+,Fe3+,Zn2+ в присутствии Al3+.
Пространственные затруднения возникают и при образовании комплексов с вынужденной конфигурацией. Так, линейный триэтилентетрамин образует с ионами Cu2+ более устойчивый хелат, чем разветвлённый:
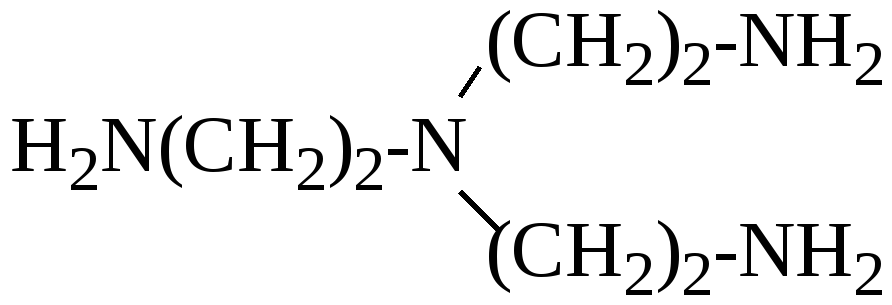
В первом случае возможна более благоприятная для Cu2+ плоская квадратная конфигурация, во втором требуется не характерная для Cu2+ тетраэдричекая структура. Для Zn2+, наоборот, предпочтительнее тетраэдрическая конфигурация, поэтому с разветвлённым амином комплекс Zn2+ более устойчив.
3.5. Кинетика и механизм реакций обмена лигандов
В общем случае реакции замещения лигандов по своему характеру нуклеофильные, так как замещаемый лиганд уносит электронную пару, ранее образовывавшую σ-связь металл-лиганд, а замещающий лиганд приносит пару электронов и поэтому занимает положение с низкой электронной плотностью. По аналогии с органическими соединениями эти процессы обозначаются как SN-процессы (нуклеофильное замещение). Возможны два основных пути протекания реакции в зависимости от того, происходит ли предварительная диссоциация реагирующего комплекса (мономолекулярный процесс SN1):
медленная
M-X = M+X
быстрая
M +Y → MY
Или важной стадией является бимолекулярный процесс замещения SN2, скорость которого зависит от концентрации как комплекса, так и замещающего лиганда:
медленная быстрая
M-X + Y = MXY → MY + X
Следовательно, SN1- механизм должен привести к активированному комплексу, в котором ион металла имеет меньшее координационное число, чем в исходном комплексе, тогда как SN2 –механизм требует увеличения числа присоединённых лигандов в переходном состоянии.
Необходимо далее рассмотреть разность энергии между реагирующим комплексом и этими переходными состояниями. Если в комплексе нет π–связей металл-лиганд, то величину скорости можно предсказать, предполагая электростатическое взаимодействие между ионами металла и лигандами. Это положение иллюстрирует табл.9.
Таблица 9. Влияние изменения заряда и размера
на скорость SN1- и SN2- процессов
|
Изменение |
Влияние на скорость SN1- процесса |
Влияние на скорость SN2- процесса |
|
повышение степени окисления металла |
понижение |
реакция не идёт |
|
увеличение радиуса иона металла |
повышение |
повышение |
|
увеличение отрицательного заряда замещающего лиганда |
не влияет |
повышение |
|
увеличение размера замещающего лиганда |
не влияет |
понижение |
|
увеличение отрицательного заряда замещаемого лиганда |
понижение |
понижение |
|
увеличение размера замещаемого лиганда |
повышение |
реакция не идёт |
|
увеличение отрицательного заряда других лигандов |
повышение |
реакция не идёт |
|
увеличение размера других лигандов |
повышение |
понижение |
Расчёты, проведённые в соответствии с теорией поля лигандов, показали, что, в частности, система с высокой энергией стабилизации поля лигандов будет исключительно инертной в своих реакциях, так как, вероятно, значительная часть этой энергии будет потеряна при переходе в состояние активированного комплекса независимо от механизма. Так, октаэдрический комплекс Ni(II) имеет энергию стабилизации поля лигандов, равную 1,2Δ, а пятикоординационный комплекс Ni(II) с конфигурацией квадратной пирамиды (предполагаемое промежуточное состояние в SN1-механизме) будет иметь энергию стабилизации поля лигандов 1,0Δ. Разность 0,2Δ должна составлять часть энергии активации.
Следует отметить, что большинство детальных исследований реакций замещения в октаэдрических комплексах было выполнено на инертных производных Cr(III) и Co(III). Было показано, что для подобных комплексов реакции замещения протекают, в основном, по SN1- механизму.
В качестве примера рассмотрим реакцию щелочного гидролиза [Co(NH3)5Cl]2+ :
[Co(NH3)5Cl]2+ + OH- = [Co(NH3)5OH]2+ + Cl- .
Данная реакция имеет второй порядок, причём, как по комплексу, так и по ОН- порядок равен единице. Хотя это, как может показаться, предполагает SN2-механизм, экспериментальные данные лучше объясняются при помощи устанавливающегося сначала кислотно-основного равновесия, включающего образование амидо-комплекса. Вслед за этим происходит диссоциация сопряжённого основания, которая и определяет скорость всего процесса, т.е. SN1- механизм:
быстрая
[Co(NH3)5Cl]2+ + OH- = [Co(NH3)4(NH2)Cl]+ + H2O ,
медленная
[Co(NH3)4(NH2)Cl]+ → [Co(NH3)4(NH2)]2+ + Cl- ,
быстрая
[Co(NH3)4(NH2)]2+ + H2O → [Co(NH3)5OH]2+ .
Однако следует подчеркнуть, что во многих случаях механизм реакции представляет нечто среднее между двумя крайними случаями: SN1 и SN2.
В зависимости от скорости обмена лигандов различают лабильные и инертные комплексы. Если при комнатной температуре реакция комплекса протекает за время смешения реагентов, комплекс относится к лабильным. Если реакция комплекса протекает с измеримой скоростью, и половина жизни комплекса более двух минут, такие комплексы относятся к инертным. Например, константа скорости изотопного обмена воды во внутренней координационной сфере для инертного комплекса [Ni(H2O)6]2+ равна 3,3104 с-1, а для лабильного [Cr(H2O)6]3+ - 510-7 с-1. Однако следует отметить, что понятия лабильности и инертности не имеют никакого отношения к термодинамической характеристике комплекса. Например, комплекс [Co(NH3)6]3+ устойчив и инертен, а комплекс [CrCl2(OH2)4]+ малоустойчив, но также инертен. В то же время комплексы [HgBr4]2- и [PtBr4]2- почти не различаются по устойчивости, однако [PtBr4]2- намного инертнее, чем [HgBr4]2-.
