
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
Глава 4. Координационные соединения металлов
В этой главе рассматриваются наиболее типичные координационные соединения металлов, важные для понимания способов получения, структуры и химических свойств комплексов. Особое внимание уделено координационным соединениям, имеющим биологическое значение.
Ионы металлов играют чрезвычайно важную роль во множестве самых разнообразных биологических процессов.
Среди биометаллов есть элементы, образующие преимущественно ионные (Na,K) и ковалентные связи(Mo,Zn), сильные комплексообразователи (Fe3+,Co2+,Cu2+,Zn2+). Однако и менее прочные комплексы, образованные, например, ионами Ca2+, Mg2+, и даже ионами щелочных металлов Na+ и K+ с участием макроциклических лигандов играют важную биологическую роль.
4.1. Подгруппа железа
4.1.1. Железо
При нагревании порошка железа в струе СО при 150-200оС под давлением ~100атм. образуется пентакарбонил железо [Fe(CO)5]: Fe + 5CO = [Fe(CO)5] .
[Fe(CO)5] – это легколетучая жидкость ( tкип. =103оС, tпл. =20оС ) желтоватого цвета, очень ядовитая и образующая с воздухом взрывчатые смеси. Однако пентакарбонил железо проявляет свойства антидетонатора при введении его добавок в моторное топливо. Молекула Fe(CO)5 имеет конфигурацию тригональной бипирамиды, что соответствует dsp3 – гибридизации σ-связы-вающих орбиталей атома железа:
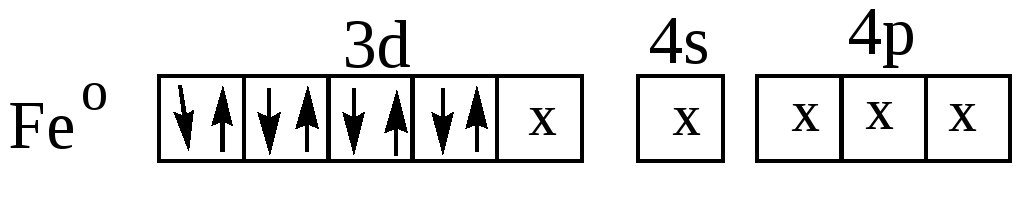
Fe → CO CO → Fe
на π-связь на σ- связь
Несмотря на нулевую степень окисления железа, пентакарбонил железо – довольно устойчивое соединение с ковалентным типом связи. Но химическая связь не ограничивается донорно-акцепторным взаимодействием, а включает и π –дативную связь.
При нагревании карбонил разрушается, что используется для получения чистейшего железа.
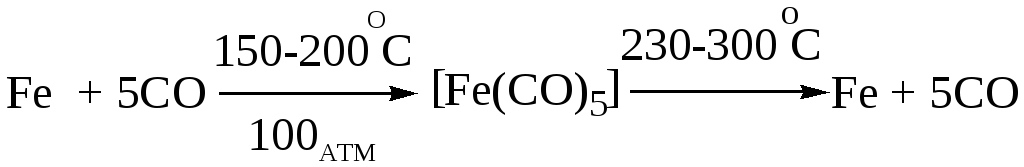
На первой стадии угарный газ избирательно реагирует с железосодержащим сырьём с получением карбонила железа, на второй стадии термическое разложение Fe(CO)5 даёт чистое железо.
Карбонил железа может окисляться и восстанавливаться, чаcтично или полностью сохраняя координированные молекулы СО. Например, в жидком аммиаке реагирует с натрием:
[Fe(CO)5] + 2Na = Na2[Fe(CO)4] + CO ,
а в спиртовом растворе со щёлочью:
[Fe(CO)5] + 4KOH = K2[Fe(CO)4] + K2CO3 + 2H2O .
Соединения типа K2[Fe(CO)4] являются солями. Железо в этом комплексе проявляет степень окисления –2.
Для
иона железа (II)
наиболее типично координационное число
6, что соответствует октаэдрическому
расположению связей в комплексах.![]() В
водных растворах существуют катионные
аквакомплексы [Fe(H2O)6]2+,
имеющие бледно-зелёную окраску.
В
водных растворах существуют катионные
аквакомплексы [Fe(H2O)6]2+,
имеющие бледно-зелёную окраску.
Гексааквакомплексы образуются при растворении в воде солей Fe(II), при взаимодействии с разбавленными кислотами Fe, FeO, Fe(OH)2, FeS, FeCO3. Например:
Fe +2H3O+ + 4H2O = [Fe(H2O)6]2+ + H2 ,
FeO + 2H3O+ + 3H2O = [Fe(H2O)6]2+ ,
FeS + 2H3O+ + 4H2O = [Fe(H2O)6]2+ + H2S .
Железо (II) образует соли почти со всеми анионами. При выпаривании из водных растворов обычно выделяются зелёные кристаллогидраты. Например, Fe(NO3)2·6H2O, FeBr2·6H2O,
(NH4)2Fe(SO4)2·6H2O(соль Мора).
За счёт потери одного электрона ион [Fe(H2O)6]2+ легко окисляется до [Fe(H2O)6]3+. Стандартный потенциал системы [Fe(H2O)6]3+ + ē = [Fe(H2O)6]2+ φо298 = 0,77В. Поэтому ион Fe2+ может окисляться молекулярным кислородом, стандартный потенциал которого равен 1,23В :
4[Fe(H2O)6]2+ + O2 + 4H3O+ = 4[Fe(H2O)6]3+ + 6H2O .
В аналитической практике для количественного определения Fe2+ используется реакция:
5[Fe(H2O)6]2++MnO4- + 8H3O+ = 5[Fe(H2O)6]3++[Mn(H2O)6]2++6H2O.
При взаимодействии безводных солей железа (II) с аммиаком образуются аммиакаты. Они устойчивы лишь в твёрдом состоянии и в насыщенных водных растворах аммиака. При растворении в воде аммиакаты железа (II) легко разрушаются:
[Fe(NH3)6]Cl2 + 2H2O = Fe(OH)2 + 4NH3 + 2NH4Cl .
Ферраты(II) - анионные комплексы Fe(II) обычно имеют тетраэдрическую структуру, в большинстве своём малостойки,
например, [FeCl4]- и [Fe(NCS)4]-.
Гексагидроксоферраты(II) [Fe(OH)6]4-, которые образуются при кипячении в восстановительной атмосфере в концентрированных растворах щелочей Fe(OH)2, в воде полностью разрушаются.
Из анионных комплексов железа(II) наиболее устойчив и легко образуется цианидный комплекс [Fe(CN)6]4- (β6=8·1036):
6KCN + FeSO4 = K4[Fe(CN)6] + K2SO4 .
Образование цианидных комплексов объясняется так же, как и карбонильных. В образовании химической связи принимают участие все валентные электроны и орбитали d-элемента за счёт донорно-акцепторного и дативного механизмов. Из цианоферратов(II) наиболее широко применяется гексацианоферрат(II) калия K4[Fe(CN)6]·3H2O . Раньше его получали сплавлением кровяных отбросов боен с поташем и железными опилками, поэтому одно из названий гексацианоферрата(II) калия – « жёлтая кровяная соль». Жёлтая кровяная соль используется в аналитической практике для обнаружения ионов Fe3+:
FeCl3 + K4[Fe(CN)6] = K[Fe+3Fe+2(CN)6] + 3 KCl .
Образуемое при этом комплексное соединение интенсивно синего цвета называется «берлинской лазурью».
Анионные комплексы у Fe(III) устойчивее, чем у Fe(II). Свежеосаждённый Fe(OH)3 растворяется в концентрированных щелочах, образуя гексагидроксоферраты(III) [Fe(OH)6]3-. Кислотные свойства проявляют и другие ферраты(III), например: [FeF6]3-, [FeCl4]-, [Fe(NCS)6]3- .
Тетраэдрический хлоридный комплекс [FeCl4]- образуется в сильнокислой среде. При разбавлении водой этот комплекс переходит в октаэдрический комплекс [Fe(H2O)2Cl4]-.
Из анионных комплексов железа(III) также наиболее устойчив гексацианоферрат(III) [Fe(CN)6]3- (β6 = 8·1043).
Наибольшее значение из цианоферратов(III) имеет «красная кровяная соль» K3[Fe(CN)6]. Эта соль используется в аналитической практике для обнаружения ионов Fe2+:
FeCl2 + K3[Fe(CN)6] = K[Fe+2Fe+3(CN)6] + 2KCl .
Образуемое при этом комплексное соединение интенсивно синего цвета называется « турнбуллевой синью».
Как показали исследования, турнбуллева синь и берлинская лазурь полностью идентичны. Их кристаллы образованы полиядерными комплексами [Fe2(CN)6]- и ионами K+ .
Хотя общая константа устойчивости (β6) у гексацианидного комплекса Fe(III) намного больше, чем Fe(II) (1043 >10 36), [Fe(CN)6]4- в кинетическом отношении более инертен, чем [Fe(CN)6]3- . Например, в водных растворах обмен:
[Fe(CN)6]4- + H2O [Fe(CN)5(OH2)]3- + CN-
идёт со значительно меньшей скоростью, чем в случае красной кровяной соли. Поэтому жёлтая кровяная соль менее токсична, чем красная, так как у жёлтой кровяной соли освобождается меньше ионов CN- в результате обмена. Энергетическая диаграмма [Fe(CN)6]4- согласно теории поля лигандов представлена на рис. 30.
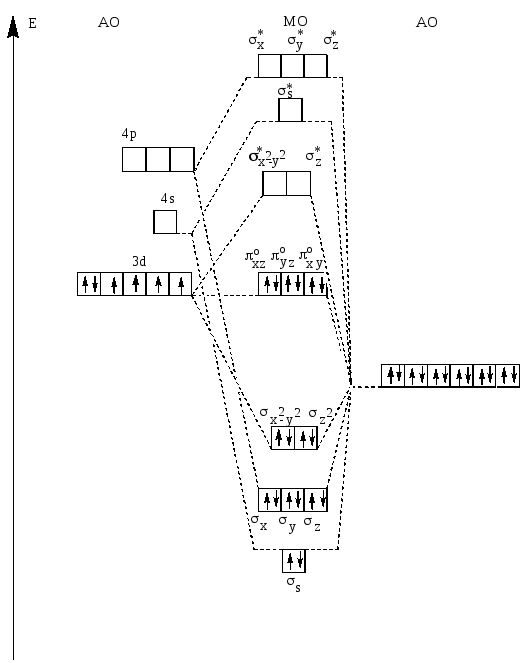
Рис. 30. Энергетическая диаграмма орбиталей октаэдрического комплекса [Fe(CN)6]4-.
Из диаграммы следует, что энергия 2р-электронов лиганда понижается в результате их размещения на связывающих МО комплекса [Fe(CN)6]4-. Энергия спаренных 3d- электронов центрального иона Fe2+ не изменяется : шесть электронов размещаются на несвязывающих орбиталях, имеющих π– симметрию. Разрыхляющие орбитали, расположенные на более высоком энергетическом уровне и имеющие σ- симметрию, остаются вакантными. Таким образом, система в целом понизила свою энергию. Если учесть π- дативную связь, то понижение энергии системы ещё существеннее. Энергия 2рπ- разрыхляющих орбиталей CN- ниже, чем энергия несвязывющих 3d-электронов Fe2+ . Образование
π- дативной связи энергетически выгодно: 3d-электроны понижают при этом свою энергию и энергию системы в целом. Это приводит к увеличению величины расщепления Δо, таким образом, π- дативная связь ещё более стабилизирует комплекс [Fe(CN)6]4-. Энергетическая диаграмма для [Fe(CN)6]3- сходна с энергетической диаграммой для [Fe(CN)6]4-, но отличается тем, что на несвязывающих МО, образовавшихся на основе
3d- орбиталей Fe3+, имеющих π- симметрию, располагается не шесть, а пять электронов. В результате, особенно при учёте
π-дативного взаимодействия, стабилизация системы несколько меньше, чем для комплекса железа(II). Поэтому связи в комплексе железа(III) более подвержены диссоциации и обмену.
В водных растворах существуют катионные светло-фиолетовые аквакомплексы [Fe(Н2O)6]3+. Из кислых растворов выделяются кристаллогидраты, например:FeCl3 ·6H2O (жёлто-бурого цвета), Fe2(SO4)3 ·10H2O(жёлтого цвета),
Fe(NO3)3 ·9H2O(жёлто-бурого цвета).
В нейтральных растворах соли Fe(III) подвергаются протолизу (гидролизуются) в большей степени, чем соли Fe(II). Ион Fe3+ оказывает сильное поляризующее действие на воду, входящую в координационную сферу. Известно, что для этой воды рКа= 2, что представляет довольно сильную кислоту, тогда как для обычной воды рКа=16. В то же время для воды в координационной сфере Fe2+ рКa =11. Вследствие гидролиза водные растворы солей Fe3+ имеют сильно кислую реакцию ( рН=2-3). Начальные стадии гидролиза можно описать уравнениями:
[Fe(H2O)6]3+ + H2O = [Fe(H2O)5OH]2+ + H3O+ K1=8,9·10-3 ,
[Fe(H2O)5OH]2+ + H2O = [Fe(H2O)4(OH)2]+ + H3O+ K2=5,5·10-3 .
Аммиачные комплексы железа(III) так же, как и железа(II), в присутствии воды неустойчивы. Аммиакат железа [Fe(NH3)6]3+ можно получить только в безводной среде.
Особый интерес представляет низкоспиновый комплекс железа(II)- бис-циклопентадиенил железа(II) (π-C5H5)2Fe или ферроцен. Рентгеноструктурные исследования показали, что ферроцен имеет структуру сэндвича: два пятичленных кольца С5Н5 расположены параллельно друг другу, а между ними размещён атом железа (рис. 31). Экспериментально установлено, что порядок связи в ферроцене и ему подобных соединениях практически такой же, как и в бензоле. Этим объясняется ароматический характер металлоценовых соединений.
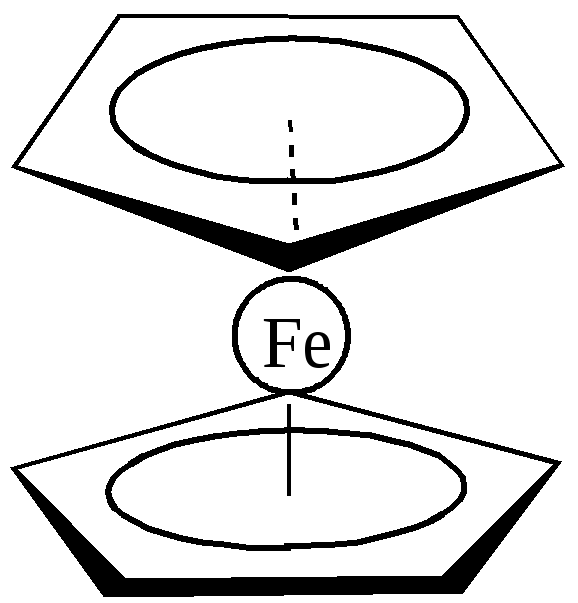
Рис. 31. Структура ферроцена.
Образование соединений, подобных ферроцену, обусловлено способностью лигандов типа С5Н5 к – дативному и – донорно-акцепторному взаимодействию с атомом d- элемента за счёт подходящих по условиям симметрии заполненных и свободных молекулярных – орбиталей. Установлено, что кольцо С5Н5- представляет собой правильный плоский пятиугольник, в котором атомные орбитали атомов углерода имеют sp2- гибридизацию (орбитали 2s,2px и 2py). Орбитали 2pz каждого из пяти атомов углерода кольца, имеющие в изолированных атомах по одному электрону, взаимодействуют друг с другом – в результате образуется пять молекулярных орбиталей симметрии - р , на которых располагаются 6 электронов. Три электронные пары занимают три наиболее низкие в энергетическом отношении молекулярные орбитали, а две молекулярные орбитали остаются вакантными. При взаимодействии с центральным ионом Fe2+ шесть электронов каждого из двух пентадиеновых колец размещаются на вакантных орбиталях железа (донорно-акцепторное взаимодействие):
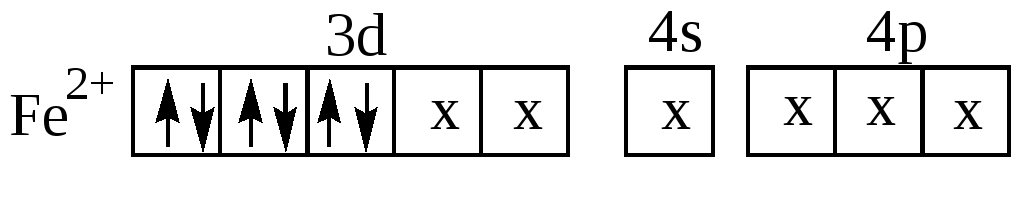
Крестиками обозначены пары электронов ионов С5Н5-(по три пары от каждого). Кроме донорно-акцепторной связи в ферроцене и его аналогах имеет место и - дативное взаимодействие – перекрывание заполненных электронами d- орбиталей железа с вакантными - орбиталями двух пентадиеновых колец. Ферроцен отличает высокая химическая и термическая устойчивость. Расплавленный ферроцен кипит на воздухе при 249оС, пары его не разлагаются до температуры 470оС. Он не разлагается концентрированной соляной кислотой и щелочами. Ферроцен используется в органическом и неорганическом синтезе как катализатор, в качестве лекарства (средство против железодефицитной анемии).
Значительно более устойчивы в растворах хелатные амминокомплексы. Важнейшим хелатным комплекса железа (II) является гем-комплекс порфирина (рис.).
Для железа также характерна степень окисления +6, которую он проявляет в ферратах(VI) [FeO4]2- .Один из способов получения ферратов(VI) – прокаливание твёрдых реагентов:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O .
