
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
3.3. Равновесия в растворах комплексных соединений
Для растворов комплексных соединений характерны следующие превращения:
а) диссоциация на комплексный и внешнесферный ионы, которая протекает почти нацело по типу диссоциации сильных электролитов, например:
K3[Fe(CN)6] 3K+ +[Fe(CN)6]3
[Cu(NH3)4](OH)2 [Cu(NH3)4]2+ + 2OH
б) образование и диссоциация комплексного иона или замещение лигандов молекулами растворителя.
Образование и диссоциация комплексных соединений происходит ступенчато:

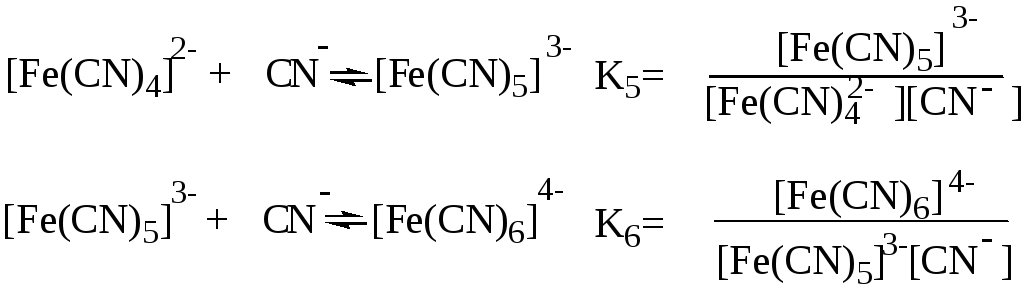
Общая константа образования комплекса 6 равна произведению ступенчатых констант образования:
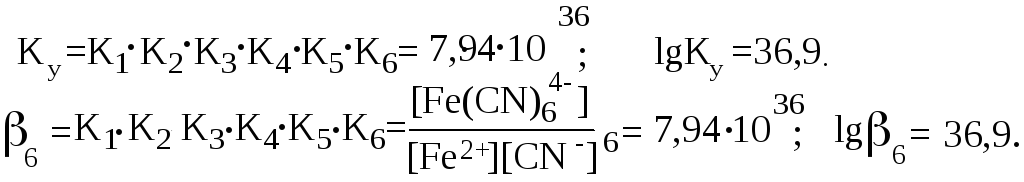
Константы Кn и (или Ку) являются термодинамическими характеристиками устойчивости комплекса в растворе. Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/ .
Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,991035 и 1,071022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов. При добавлении аммиака в водный раствор соли меди связанная с медью вода последовательно замещается аммиаком:
[Cu(H2O)4]2+ +NH3 = [Cu(NH3)(H2O)3]2+ +H2O
[Cu(NH3)(H2O)3]2+ + NH3 = [Cu(NH3)2(H2O)2]2+ +H2O
[Cu(NH3)2(H2O)2]2+ +NH3 = [Cu(NH3)3(H2O)]2+ + H2O
[Cu(NH3)3(H2O)]2+ +NH3 = [Cu(NH3)4]2+ +H2O
К этому обратимому последовательному процессу можно применить закон действующих масс. Константа равновесия, соответствующая суммарной реакции
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ +4H2O ,
является суммарной константой образования или константой устойчивости данного комплекса β4 (или Ку):

Реакцией,
обратной комплексообразованию, является
реакция диссоциации.![]() Диссоциация
также протекает ступенчато, причём при
обмене лигандов с водой координационное
число обычно остаётся неизменным. Между
константой равновесия и рК прямой и
обратной реакций имеет место следующее
соотношение:
Диссоциация
также протекает ступенчато, причём при
обмене лигандов с водой координационное
число обычно остаётся неизменным. Между
константой равновесия и рК прямой и
обратной реакций имеет место следующее
соотношение:
Ку(β)=1/Кн; рКу= рКн,где Кн-константа нестойкости (диссоциации).
3.4. Устойчивость комплексных соединений
Устойчивость комплексных соединений определяется как внешними условиями (температура, природа растворителя, ионная сила, состав раствора), которые учитываются при расчёте условной константы устойчивости, так и фундаментальными факторами. Такими факторами являются: природа центрального атома и донорных атомов лигандов, структура лигандов и стерические факторы.
3.4.1. Природа центрального атома и лигандов
Согласно теории Льюиса, комплексообразование можно рассматривать как один из видов кислотно-основных равновесий, в котором роль кислоты играет центральный ион (акцептор электронов), а роль основания –лиганды(доноры электронов). В соответствии с теорией Льюиса все кислоты и основания условно делятся на два класса: жёсткие и мягкие кислоты и основания. При оценке жёсткости и мягкости кислот и оснований учитывается их химический состав, электронное строение и сравнительная устойчивость образуемых ими кислотно-основных комплексов. Согласно принципу жёстких и мягких кислот и оснований кислотно-основные взаимодействия протекают таким образом, что жёсткие кислоты предпочтительно связываются с жёсткими основаниями, а мягкие кислоты – с мягкими основаниями. Примеры жёстких и мягких кислот и оснований приведены в табл. 5 и 6:
Таблица 5. Классификация кислот Льюиса
|
|
Жёсткие |
Промежу- Точные |
Мягкие |
|
Кислоты Льюиса (комплексо- образова- тели) |
H+,Li+,Na+, K+,Mg2+,Ca2+, Al3+,Mn2+,Cr3+, Fe3+,Co3+,Zr4+, BF3,AlCl3, HHal,CO2, NC+ |
Fe2+,Co2+,Ni2+, Cu2+,Zn2+,Ru2+, Rh3+,Ir3+,SO2, NO+,R3C+,C6H5 |
Cu+,Ag+,Au+, Au3+,Hg2+, Pb2+,Bi3+,Cd2+, Pt2+,Pt4+,Cr, Fe,I2,I+,Br+, Br2, RO+, CH3Hg, R+, алкены, хиноны |
Таблица 6. Классификация оснований Льюиса
|
|
Жёсткие |
Промежу-точные |
Мягкие |
|
Основания Льюиса (донорные атомы лигандов) |
F-,OH-,O2-H2O,CO32-, PO43-,SO42-, NO3-,NH3, N2H4,RNH2, CH3COO- ROH,RO-, R2O |
C5H5N |
R2S,R3P, R3As,CO, RNC
|
Применительно к комплексообразованию мягкость кислоты или основания Льюиса означает его склонность к образованию связей преимущественно ковалентного, а жёсткость – преимущественно ионного характера. Типичные жёсткие кислоты (катионы – комплесообразователи) имеют малый атомный или ионный радиус, высокую электроотрицательность, с трудом поляризуются (Н+,Mn2+,Cr3+,Fe3+,Co3+) и трудно восстанавливаются.
Наиболее жёсткие катионы имеют электронную структуру инертного газа и не имеют вакантных энергетически низко расположенных d-орбиталей. Катионы с частично заполненными
d-орбиталями занимают промежуточное положение. При прочих равных условиях жёсткость катиона возрастает с увеличением его заряда. Так, Fe3+ является более жёсткой кислотой Льюиса, чем Fe2+.
Лиганды с высокоотрицательными донорными атомами являются жёсткими основаниями (H2O,OH,NH3,Cl), тогда как поляризуемые лиганды – мягкие основания (SCN, CN, RS,RSH).
Мягкие кислоты имеют большие размеры и легко поляризуются (Ag+,Pd2+,Pt2+,Pt4+,Cd2+).Мягкие кислоты Льюиса имеют электроны на d-орбиталях, способные к образованию -связей в результате перекрывания с вакантными d-орбиталями мягких лигандов. Наиболее устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или мягкой кислотой и мягким основанием.
Поскольку реакции комплексообразования подразумевают взаимодействие кислот и оснований Льюиса, с увеличением основных свойств лигандов устойчивость комплексов повышается.
Например, среди однотипных соединений: [Ag(NH3)2]+ (β2=1,5107) и [Ag(CN)2] (β2=11021) более стойким является второе.
Прочность связи между лигандами и ионами-комплексообразователями зависит не только от их природы, но и от природы лиганда, находящегося в транс- положении к первому. Это явление носит название транс-эффекта. Он возрастает в ряду лигандов: H2O<OH< NH3< Cl< Br< I< NO2<CO <CN.
Чем выше транс-активность лиганда, тем менее прочна связь с комплексообразователем его транс-партнёра, и тем легче последний замещается другими лигандами.
Так, в соединении

молекула аммиака, расположенная по одной диагонали с хлором, более подвижна, чем две другие молекулы его. Взаимодействие такого соединения с соляной кислотой приводит к образованию только транс-изомера:

Аналогично, в соединении

ионы хлора, лежащие на координате хлор-платина-хлор, более подвижны, чем ионы, транс-партнёром которых является аммиак. Поэтому реакция замещения ионов хлора аммиаком происходит с образованием цис-изомера:

Во всех случаях происходит в первую очередь замещение того лиганда, транс- партнёр которого наиболее активен. Замещение молекулами воды молекул аммиака из внутренней сферы соединения

происходит медленнее, чем из соединения
 ,
,
так как бром транс-активнее, чем хлор, и аммиак в транс-положении к брому более подвижен, чем в качестве транс-партнёра к хлору.
В комплексных соединениях Co3+ группа NO2- проявляет большее транс-влияние, чем группа CNS-. Поэтому при реакции между NH4[Co(NO2)4(NH3)2] и NH4CNS происходит замещение только двух групп NO2- на группы CNS-:

Применение избытка роданида аммония не вызывает дальнейшего замещения групп NO2- в комплексе, так как группы CNS- более подвижны. В то же время благодаря большей транс-активности групп NO2- легко происходит обратный процесс:

Транс-активность лигандов влияет и на кислотные свойства комплекса. Чем выше транс-активность заместителя, расположенного по одной диагонали с водородсодержащим лигандом, тем меньше способность последнего к отщеплению протона, т.е. слабее выражены кислотные свойства комплекса. Поэтому молекула воды, стоящая в транс-положении к другой молекуле воды, обычно обладает более выраженными кислотными свойствами, чем молекула воды, транс-партнёром которой являются более транс-активные лиганды(Cl-,Br-,OH-,NO2-,NH3). Например, транс-изомер диаквадиамминплатины проявляет более сильные кислотные свойства, чем цис-изомер.

Транс- партнёром воды в случае транс-изомера является вода, а в случае цис-изомера –аммиак.рК2 для транс-изомера значительно выше, чем рК1 , так как во второй стадии реакции транс-партнёром воды является транс-активный ОН. В результате кислотность во второй стадии выше. Для цис-изомера небольшое отличие рК2 от рК1 обусловлено тем, что заряд катиона[Pt(NH3)2(H2O)2]+меньше, чем катиона [Pt(NH3)2(H2O)]2+ .
