
- •Оглавление
- •Тема 2. Строение вещества 6
- •Тема 1. Химический эквивалент. Закон эквивалентов.
- •Тема 2. Строение вещества
- •Тема 3. Основные закономерности протекания химических процессов
- •Тема 5. Растворы электролитов
- •Тема 6. Общие свойства растворов
- •Тема 7. Комплексные соединения
- •Тема 8. Электрохимические процессы
Тема 2. Строение вещества
Задание 1. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 2):
-
напишите электронные формулы, подчеркните валентные электроны и определите семейство;
-
укажите значения квантовых чисел для валентных электронов;
-
распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
-
объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
-
определите степени окисления элементов в молекуле;
-
составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
-
охарактеризуйте химические свойства элементов, заполнив таблицу:
|
Элемент |
Формула оксида |
Формула гидроксида |
Формула водородного соединения |
|
|
|
|
|
|
|
|
|
|
|
Химический характер |
|
|
|
Тема 3. Основные закономерности протекания химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 3).
-
Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин
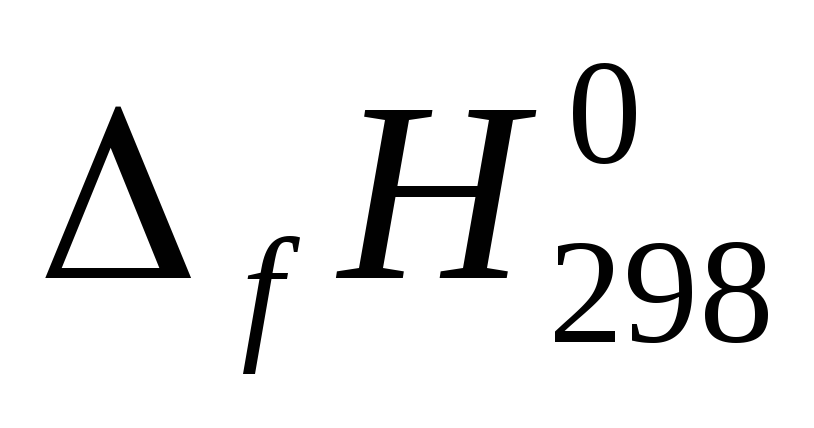 и
и
 .
. -
Вычислите изменение энтальпии реакции
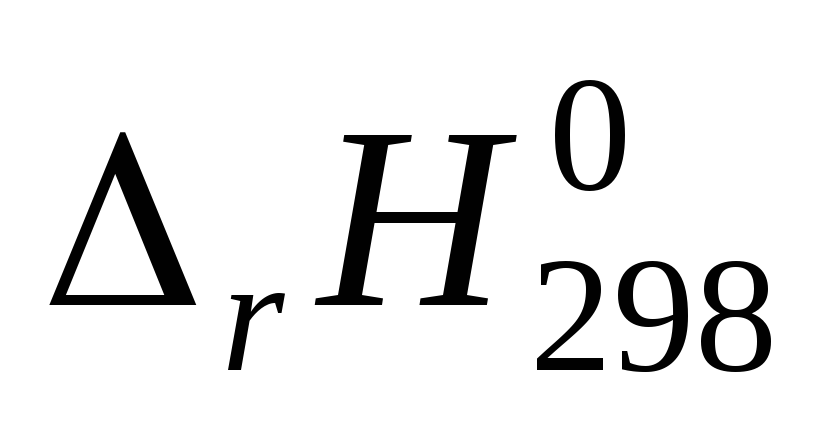 и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции.
и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции. -
По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции
 .
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак
.
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак
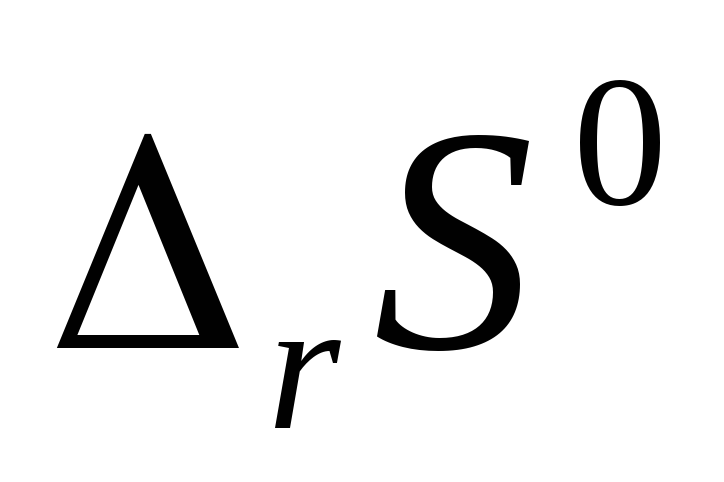 .
. -
Вычислите энергию Гиббса прямой реакции в стандартных условиях
 и установите возможность самопроизвольного
протекания реакции.
и установите возможность самопроизвольного
протекания реакции. -
Определите температуру, при которой реакция находится в равновесии (Тр).
-
Рассчитайте
 при
Т=Тр–100,
Т=Тр+100.
при
Т=Тр–100,
Т=Тр+100. -
Постройте график зависимости
 от
Т и обозначьте на графике область
температур самопроизвольного протекания
реакции.
от
Т и обозначьте на графике область
температур самопроизвольного протекания
реакции. -
Вычислите значения константы равновесия Кc для температур: Т=Тр, Т=Тр–100, Т=Тр+100. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Таблица 2
|
№ варианта |
Формула вещества |
№ варианта |
Формула вещества |
№ варианта |
Формула вещества |
|
1 |
BF3 |
10 |
AlCl3 |
19 |
PH3 |
|
2 |
PbCl4 |
11 |
GaCl3 |
20 |
BeCl2 |
|
3 |
H2Se |
12 |
SnCl4 |
21 |
СО2 |
|
4 |
SiCl4 |
13 |
CaH2 |
22 |
SnCl2 |
|
5 |
PI3 |
14 |
SbBr3 |
23 |
PI3 |
|
6 |
AsCl3 |
15 |
HgCl2 |
24 |
AsF5 |
|
7 |
SbH3 |
16 |
H2O |
25 |
CdF2 |
|
8 |
BeF2 |
17 |
BI3 |
|
|
|
9 |
PbCl2 |
18 |
CH4 |
|
|
Задание 1. Дано уравнение реакции (см. вариант в табл. 3).
-
Запишите кинетические уравнения скоростей прямой
 и обратной
и обратной
 реакций.
Гомо- или гетерогенной является данная
реакция?
реакций.
Гомо- или гетерогенной является данная
реакция? -
Рассчитайте скорость прямой реакции
 в начальный момент времени (при Со).
Как изменится скорость прямой реакции
к моменту времени
в начальный момент времени (при Со).
Как изменится скорость прямой реакции
к моменту времени
 ,
когда прореагирует 20 % вещества В?
,
когда прореагирует 20 % вещества В? -
Рассчитайте увеличение скорости прямой реакции
 при
одновременном повышении давления в
системе в 2 раза и температуры
при
одновременном повышении давления в
системе в 2 раза и температуры
 на
20 С
при =2.
на
20 С
при =2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 3).
-
Запишите выражение для константы равновесия химической реакции через концентрации Кс.
-
Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30% вещества В и вычислите константу равновесия.
-
Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V или Т).
Задание 3. Используя вещество с молярной массой М = 100 г/моль было приготовлено пять растворов с различной концентрацией Со (см. вариант в табл. 4).
-
Рассчитайте массу вещества, адсорбированного из 100 мл каждого раствора адсорбентом (m, г), если равновесные концентрации [C1]=0,002, [C2]=0,01, [C3]=0,04, [C4]=0,16, [C1]=0,63 моль/л. Вычислите величину адсорбции (Г).
-
Постройте график зависимости величины адсорбции (Г) от равновесной концентрации в натуральной и логарифмической системе координат и вычислите константы уравнения Фрейндлиха.
Таблица 3
|
№ варианта |
1, 2, 3 |
Изменение внешних условий |
|||||
|
аА + bВ cC + dD |
Cо(А), моль/л |
Cо(В), моль/л |
Сисх |
Р |
V |
Т |
|
|
1 |
CН4(г) + 2 Н2О(г) CO2(г) + 4 Н2(г) |
1 |
2 |
↑ |
↓ |
↓ |
↓ |
|
2 |
СS2(г) + 4 Н2(г) CH4(г) + 2 Н2S(г) |
2 |
1 |
↑ |
↑ |
↑ |
↓ |
|
3 |
SO2(г) + 3 F2(г) SF6(г) + O2(г) |
2 |
3 |
↓ |
↓ |
↑ |
↑ |
|
4 |
2 BCl3(г) + 3 H2(г) 2 B + 6 HCl(г) |
1 |
2 |
↑ |
↑ |
↓ |
↓ |
|
5 |
2 AsCl3(г) + 3 H2(г) 2 As(г) + 6 HCl(г) |
1 |
2 |
↑ |
↑ |
↓ |
↓ |
|
6 |
2 H2S(г) + 3 O2(г) 2 SO2(г) + 2 Н2О(ж) |
2 |
4 |
↓ |
↓ |
↑ |
↑ |
|
7 |
2 NO(г) + 2H2S (г) N2 + 2H2O(г) + 2 S(Т) |
1 |
3 |
↑ |
↑ |
↓ |
↓ |
|
8 |
СО(г) + 3 Н2(г) СH4(г) + Н2О (г) |
2 |
2 |
↓ |
↓ |
↑ |
↑ |
|
9 |
2 NO2(г) + F2(г) 2 (NO2)F(г) |
3 |
2 |
↓ |
↓ |
↑ |
↑ |
|
10 |
4 HCl(г) + О2(г) 2 H2О(г) + 2 Cl2(г) |
4 |
2 |
↑ |
↑ |
↓ |
↓ |
|
11 |
2 СO(г) + SO2(г) = 2 CO2(г) + S(т) |
3 |
2 |
↓ |
↓ |
↑ |
↑ |
Окончание табл. 3
|
12 |
2 NO(г) + 2 H2(г) = N2(г) + 2 H2O(ж) |
1 |
3 |
↑ |
↑ |
↓ |
↓ |
|
13 |
2 NO(г) + 2 SO2(г) N2(г) + 2 SO3(г) |
2 |
1 |
↑ |
↑ |
↑ |
↑ |
|
14 |
2 PF3(г) + О2(г) 2 POF3(г) |
4 |
2 |
↓ |
↓ |
↑ |
↑ |
|
15 |
2 H2S(г) + SO2(г) 3 S(т) + 2 H2O(г) |
3 |
2 |
↓ |
↓ |
↓ |
↓ |
|
16 |
2 PCl3(г) + O2(г) 2 PCl3O(г) |
3 |
1 |
↑ |
↑ |
↑ |
↑ |
|
17 |
SiCl4(г) + 2 Н2(г) Si(т) + 4 HCl(г) |
1 |
0,5 |
↓ |
↓ |
↓ |
↓ |
|
18 |
2 NO(г) + Cl2(г) 2 NOCl(г) |
3 |
2 |
↑ |
↑ |
↑ |
↓ |
|
19 |
2 CO(г) + 2 H2(г) = CH4(г) + CO2(г) |
2 |
1 |
↓ |
↑ |
↑ |
↓ |
|
20 |
CCl4(г) + 2 Н2(г) CН4(г) + Cl2(г) |
1 |
3 |
↑ |
↓ |
↑ |
↑ |
|
21 |
СO2(г) + 2 NH3(г) = СО(NH2)2(т) + H2O(г) |
2 |
1,5 |
↑ |
↓ |
↓ |
↑ |
|
22 |
2 NO2(г) + O3(г) = N2O5(г) + O2(г) |
3 |
2 |
↓ |
↑ |
↓ |
↑ |
|
23 |
CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т) |
1,5 |
2 |
↑ |
↓ |
↑ |
↑ |
|
24 |
SiH4(г) + 2 O2(г) = 2 H2O(г) + SiO2(т) |
2 |
0,5 |
↑ |
↑ |
↓ |
↑ |
|
25 |
2 NO(г) + 2 H2(г) = N2(г) + 2 H2O(ж) |
3 |
2 |
↓ |
↑ |
↑ |
↓ |
Таблица 4
|
№ варианта |
m, г |
Cо, моль/л |
||||
|
1 |
2 |
3 |
4 |
5 |
||
|
1 |
0,9 |
0,010 |
0,023 |
0,065 |
0,200 |
0,698 |
|
2 |
0,6 |
0,005 |
0,015 |
0,050 |
0,180 |
0,670 |
|
3 |
2,0 |
0,030 |
0,045 |
0,084 |
0,212 |
0,695 |
|
4 |
0,9 |
0,012 |
0,024 |
0,060 |
0,186 |
0,665 |
|
5 |
0,4 |
0,004 |
0,014 |
0,047 |
0,173 |
0,662 |
|
6 |
0,18 |
0,008 |
0,018 |
0,050 |
0,172 |
0,645 |
|
7 |
0,4 |
0,003 |
0,013 |
0,046 |
0,173 |
0,654 |
|
8 |
0,7 |
0,005 |
0,014 |
0,045 |
0,168 |
0,637 |
|
9 |
0,6 |
0,010 |
0,021 |
0,054 |
0,180 |
0,655 |
|
10 |
0,5 |
0,005 |
0,015 |
0,047 |
0,167 |
0,645 |
|
11 |
0,6 |
0,007 |
0,016 |
0,047 |
0,168 |
0,639 |
|
12 |
0,5 |
0,008 |
0,017 |
0,048 |
0,169 |
0,642 |
|
13 |
0,7 |
0,005 |
0,014 |
0,045 |
0,167 |
0,639 |
|
14 |
0,95 |
0,011 |
0,025 |
0,067 |
0,204 |
0,705 |
|
15 |
0,65 |
0,005 |
0,016 |
0,052 |
0,182 |
0,674 |
|
16 |
2,8 |
0,033 |
0,048 |
0,088 |
0,217 |
0,702 |
|
17 |
0,95 |
0,013 |
0,026 |
0,062 |
0,189 |
0,678 |
|
18 |
0,75 |
0,011 |
0,030 |
0,079 |
0,242 |
0,806 |
|
19 |
0,85 |
0,009 |
0,019 |
0,051 |
0,173 |
0,646 |
|
20 |
0,6 |
0,008 |
0,018 |
0,055 |
0,190 |
0,695 |
|
21 |
0,18 |
0,008 |
0,018 |
0,050 |
0,172 |
0,645 |
|
22 |
0,9 |
0,012 |
0,024 |
0,060 |
0,186 |
0,665 |
|
23 |
0,4 |
0,004 |
0,014 |
0,047 |
0,173 |
0,662 |
|
24 |
0,5 |
0,005 |
0,015 |
0,047 |
0,167 |
0,645 |
|
25 |
0,6 |
0,007 |
0,016 |
0,047 |
0,168 |
0,639 |
